Medizinprodukte Einmaleins // Herzschrittmacher

DATUM
03. November 2020
AUTOR
Alex | Product Manager
Was sind Herzschrittmacher?
Ein Herzschrittmacher ist ein Gerät, das unter der Haut in der Brust eines Patienten platziert wird, um bei unregelmäßigem Herzschlag (“Arrhythmie”) den Herzmuskel elektrisch zur Kontraktion zu stimulieren.
Laut Grand View Research wurde der weltweite Markt für Herzschrittmacher im Jahr 2019 auf USD 4,5 Milliarden geschätzt und soll in den nächsten sieben Jahren mit einer durchschnittlichen jährlichen Wachstumsrate von 2,9% wachsen. Es gibt viele Faktoren, die den Markt vorantreiben, wie z.B. eine steigende Zahl von Herz-Kreislauf-Erkrankungen, technologische Innovationen sowie eine vorteilhafte Regierungspolitik. Der Hauptgrund für das Marktwachstum ist jedoch die hohe Anzahl der Herz-Kreislauf-Erkrankungen. Einerseits sind Herzerkrankungen hierfür eine der weltweiten Haupttodesursachen. Andererseits wird die finanzielle Belastung bis 2030 voraussichtlich mehr als 1.044,0 Milliarden USD betragen, was die medizinische Bedeutung und Notwendigkeit von Herzschrittmachern verstärkt.
Die Herzschrittmacher-Branche ist – wie die meisten anderen medizinischen Branchen – stark von der COVID-19-Pandemie betroffen. Die neuartige Krankheit hat auch schwerwiegende Auswirkungen auf Patienten, die an Herz-Kreislauf-Erkrankungen leiden. Nach Angaben der Centers for Disease Control and Prevention erhöht eine Herz-Kreislauf-Erkrankung das Risiko einer schweren Erkrankung durch COVID-19. Folglich wird die Behandlung dieser Krankheiten u.A. mit Herzschrittmachern noch wichtiger.
Als Medizingeräte einer hohen Risikoklasse werden Herzschrittmacher typischerweise in die Klasse III eingestuft. In diesem nehmen wir Herzschrittmacher genauer unter die Lupe und gehen darauf ein, was Hersteller im Rahmen der Zertifizierung mit der neuen Medizinprodukteverordnung (EU-MDR) beachten müssen.
Wie werden Herzschrittmacher eingesetzt?
Das Einsetzen eines herkömmlichen Herzschrittmachers erfordert keine Operation am offenen Herzen und die meisten Patienten werden innerhalb von 24 Stunden aus dem Krankenhaus entlassen. Während der Operation wird ein kleiner Einschnitt unterhalb des Schlüsselbeins des Patienten vorgenommen. Eine oder zwei Elektroden (dünne, biegsame Leitungen) werden dann durch eine Vene bis zum Herz des Patienten geführt. Danach verbindet der Chirurg die Elektrode mit dem Herzschrittmacher, der unter die Haut im oberen Brustkorb geschoben wird. Das Gerät wird programmiert und getestet, um sicherzustellen, dass es einwandfrei funktioniert. Anschließend wird der Einschnitt geschlossen.
Welche Herzschrittmacher gibt es?
Es gibt drei Arten von Herzschrittmachern, die basierend auf den Symptomes und der spezifischen Herzerkrankung des Patienten ausgewählt werden.
- Einkammer-Schrittmacher. Bei diesem Herzschrittmacher wird nur eine Elektrode an den Schrittmacher angeschlossen. Diese ist entweder im Vorhof oder der Hauptkammer des Herzens verankert und sendet von dort aus Impulse.
- Zweikammer-Schrittmacher. Hier werden zwei Elektroden verankert, eine im Vorhof, die andere in der Hauptkammer. Dieser Typ kann dadurch wechselweise Impulse aussenden.
- Kardiale Resynchronisationstherapie. Die kardiale Resynchronisationstherapie (oder biventrikuläres “Pacing”). Hierbei werden drei Elektroden mit dem Herzen verbunden, mit dem rechten Vorhof und beiden Herzkammern. So können die Aktionen beider Herzkammern synchronisiert werden, wenn eine Herzinsuffizienz vorliegt.
Wie sieht das neue Verfahren zur Zertifizierung und Überwachung von Herzschrittmachern im Rahmen der EU-MDR aus?
Herzschrittmacher sind ein Medizinprodukt der Klasse III, die nach Angaben des Johner-Instituts etwa 2% des Marktanteils der Medizinprodukte ausmachen. Bezüglich der Konformitätsbewertung und der Überwachung nach dem Inverkehrbringen (Post-Market Surveillance / PMS) geht, unterliegen Herzschrittmacher mehreren wichtigen gesetzlichen Anforderungen. In den nächsten Abschnitten werden wir analysieren, wie die EU-MDR diesen Prozess verändern wird.
Konformitätsbewertung
Das Konformitätsbewertungsverfahren dient als Beweis dafür, dass die allgemeinen Sicherheits- und Leistungsanforderungen des Medizinprodukts erfüllt sind. Es liegt in erster Linie in der Verantwortung des Medizinprodukteherstellers, ein solches Verfahren durchzuführen. Die Konformitätsbewertung unterliegt jedoch den regulatorischen Anforderungen der Region, also der EU-MDR in Europa.
Das Konformitätsbewertungsverfahren ist im Artikel 52 der EU-MDR beschrieben. Die Art der Bewertung hängt von der Risikoklasse des Produkts und den spezifischen Merkmalen bestimmter Produkte ab.
Nach MDR-Recht ist für die Produkte fast aller Klassen (mit Ausnahme der Klasse I) eine Benannte Stelle erforderlich. Für Herzschrittmacher als Produkt der Klasse III benötigen Hersteller entweder ein vollständiges Qualitätsmanagementsystem (QMS) nach ISO 13485, das in Anhang IX der EU-MDR spezifiziert ist, oder sie müssen Anhang XI befolgen.
Für Medizinprodukte der Klassen IIb und III ist eine zusätzliche Untersuchung erforderlich, die in Anhang X des EU-MDR detailliert aufgeführt ist. Diese ist jedoch nur erforderlich, wenn Anhang IX nicht befolgt wird, d.h. wenn der Hersteller kein vollständiges QMS-System hat). Diese Musterprüfung ist das Verfahren, bei dem die Benannte Stelle prüft, ob der Herzschrittmacher den einschlägigen Bestimmungen entspricht.
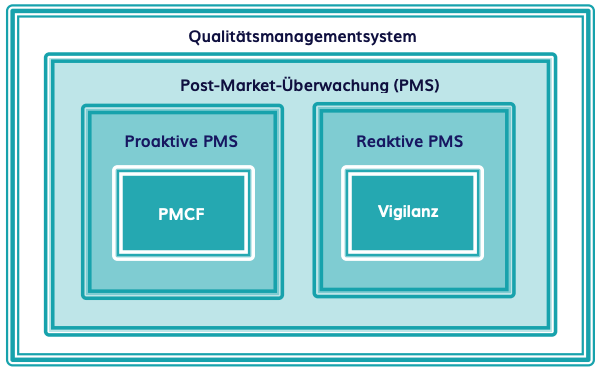
Post-Market Surveillance
Unter Post-Market Surveillance (PMS) versteht man die Überwachung der Sicherheit und Leistung eines Gerätes, nachdem es auf den Markt gebracht wurde. Dieser Prozess ist von entscheidender Bedeutung, da bestimmte Risiken oder Probleme eines Herzschrittmachers möglicherweise erst zu einem späteren Zeitpunkt festgestellt werden. Daher müssen Hersteller nach dem Inverkehrbringen fortlaufend Daten über die Leistung ihrer Geräts sammeln, da dies einen hohen Standard der Produktqualität gewährleistet.
Im Gegensatz zur MDD, in der PMS nur kurz erwähnt wird, enthält die EU-MDR im Artikel 82 detaillierte Anforderungen an einen PMS-Plan. Für Medizinprodukte der Klasse III, wie Herzschrittmacher, muss der Hersteller ein PMS-System implementieren und aufrechterhalten, um aktiv und systematisch Daten über die Qualität, Leistung und Sicherheit des Produkts während seines gesamten Lebenszyklus zu sammeln. Dies ermöglicht es Herstellern, bei (schwerwiegenden) unerwünschten Ereignissen schnell alle notwendigen Maßnahmen wie Produktrückrufe einzuleiten.
Es gibt zwei Arten dieser Überwachung: proaktive und reaktive PMS. Reaktive PMS, auch “Vigilanz” genannt, beschreibt die Reaktion auf einen bestimmten Vorfall, wie z.B. ein (schwerwiegendes) unerwünschtes Ereignis. Bei Herzschrittmachern können dies eine Infektion an der Operationsstelle, eine Unverträglichkeit des Materials oder das Ausbleiben der Wirkung sein. Im Gegensatz dazu versucht proaktive PMS, Vorfälle zu verhindern, indem es Daten über die Leistung des Geräts sammelt. Dazu können Umfragen unter Endanwendern oder Kunden, klinische Studien nach der CE-Kennzeichnung oder die Bildung von Anwendergruppen gehören.
PMS- und PMCF-Aktivitäten in der EU-MDR-Ära meistern
Klinischer Bewertungsbericht
Der Klinische Bewertungsbericht (Clinical Evaluation Report / CER) dokumentiert die Ergebnisse einer klinischen Bewertung des Herzschrittmachers und ist ein wesentlicher Schritt zur CE-Zertifizierung. Der Bericht besteht aus analysierten klinischen Daten, die entweder aus einer klinischen Untersuchung des eigenen Produkts oder aus Ergebnissen früherer Literaturrecherchen zu gleichwertigen Geräten gewonnen wurden.
Die EU-MDR bringt neue Richtlinien für CER-Berichte mit sich, die im Artikel 61 und Anhang XIV der Verordnung zu finden sind. In der MDR ist der Umfang der CER im Vergleich zur MDD wichtiger. Der Klinische Bewertungsbericht muss während des gesamten Lebenszyklus eines Produkts aktualisiert werden. Da der Herzschrittmacher ein Medizinprodukt der Klasse III ist, muss der Bericht mindestens jährlich aktualisiert werden.
Periodic Update Safety Report
Nach der MDR müssen Hersteller außerdem regelmäßig einen Periodic Update Safety Report (PSUR) vorlegen. Dieser Bericht liefert Behörden eine Zusammenfassung der Ergebnisse und Schlussfolgerungen aus den gesammelten PMS-Daten. Hersteller von Geräten der Klasse III müssen den PSUR bei Bedarf, mindestens jedoch jährlich, gemäß Artikel 86 des MDR aktualisieren.
Ein PSUR sollte Folgendes enthalten:
- Meta-Informationen einschließlich Referenzen
- Plan-Implementierung
- Produktdaten (einschließlich Umsatz, Indikationen, Patienten)
- Überblick über die Daten (einschließlich unerwünschter Ereignisse)
- Ergebnisse der Analyse (einschließlich Trends)
- Überblick über die ergriffenen Maßnahmen (einschließlich CAPA, Wachsamkeit, FSCA)
- Schlussfolgerungen aus dem Risiko-Nutzen-Verhältnis
- Abschließende Beurteilung
Quelle: Johner Institut.
Post-Market Clinical Follow-up
Nicht zuletzt ist die klinische Nachbeobachtung nach dem Inverkehrbringen (Post-Market Clinical Follow-up / PMCF) Teil der PMS und ein kontinuierlicher und verpflichtender Prozess zur Erfassung klinischer Daten über einen Herzschrittmacher. Wie in Anhang XIV ,Teil B der EU-MDR definiert, ist PMCF “ein fortlaufender Prozess zur Aktualisierung der klinischen Bewertung […] und wird im Plan des Hersteller zur Überwachung nach dem Inverkehrbringen behandelt”. Mit anderen Worten, das Ziel der PMCF ist es, die Sicherheit und Leistungsfähigkeit des Herzschrittmachers kontinuierlich zu bestätigen. Die klinischen Daten, die zum Herzschrittmacher erhoben werden, sollten zeigen, dass seine Risiken im Zusammenhang mit seinem medizinischen Mehrwert akzeptabel bleiben.
Die PMCF-Aktivitäten können von der Analyse von Daten aus öffentlich zugänglichen Informationen in bestehenden Produkt-Registern bis hin zur Durchführung einer neuen klinischen Studie reichen. Diese Untersuchungen können in Form von digitalen Erhebungen durchgeführt werden, wie wir im nächsten Abschnitt erörtern werden.
Zeit für digitale Datenerhebung
Wie in den vorherigen Abschnitten beschrieben, erfordern PMS-Aktivitäten eine kontinuierliche und systematische Datenerhebung während des gesamten Lebenszyklus des Herzschrittmachers. Daher ist eine beträchtliche Menge an klinischen Daten erforderlich, was für viele Hersteller eine Herausforderung darstellen kann. Darüber hinaus wird die EU-MDR einige bedeutende Änderungen mit sich bringen, wie etwa strengere Kontrollen der klinischen Berichte und höhere Erwartungen hinsichtlich der Erfassung klinischer Daten für Medizinprodukte und deren CE-Kennzeichnung,
In einer kürzlich durchgeführten Umfrage über die wahren Kosten der EU-MDR haben wir die Teilnehmer gefragt, wie sie derzeit ihre PMS-Aktivitäten einschließlich ihrer PMCF-Studien verwalten. Die Ergebnisse zeigten, dass 69% Excel-Tabellen und 47% Papier verwenden und nur 11% ihre Datenerfassung mit einer elektronischen Lösung digitalisiert haben.
Der Einsatz von Electronic Data Capture (EDC)-Systemen, d.h. die Erfassung und Verwaltung von Daten auf einer digitalen Plattform, ist eine der effizientesten Möglichkeiten, PMCF-Aktivitäten in Übereinstimmung mit der EU-MDR durchzuführen. Angesichts der tiefgreifenden regulatorischen Veränderungen, die die EU-MDR mit sich bringt, glauben wir, dass papierbasierte Datenerfassungsmethoden langfristig nicht aufrechterhalten werden können. Hersteller, die sich auf diese Methoden verlassen, werden künftig vermutlich Schwierigkeiten haben, die Anforderungen an die klinische Datenerfassung zu erfüllen.
EDC-Lösungen ermöglichen es Herstellern, Daten in Echtzeit zu erfassen und in interaktiven Dashboards anzuzeigen. Solche Dashboards bieten einen Überblick über alle aktuellen Maßnahmen und relevanten Kennzahlen. Darüber hinaus ermöglicht eine digitale Lösung eine reibungslose Zusammenarbeit zwischen allen beteiligten Parteien – wie etwa Ärzten, Patienten oder Experten-Nutzergruppen für PMS-Aktivitäten.
Beispielumfrage für Herzschrittmacher
Wenn Sie sich eine Live-Umfrage für Herzschrittmacher ansehen möchten, können Sie sich hier eine PMCF-Umfrage ansehen, die mit der Climedo-Software erstellt wurde.
Alternativ können Sie diesen QR-Code mit Ihrem Smartphone einscannen:
EDC-Lösungen kennenlernen
Möchten Sie mehr darüber erfahren, wie Sie Ihre PMS-Aktivitäten digitalisieren können?
Hier erhalten Sie eine kostenlosen Testzugang: