Umfrageergebnisse: EU-MDR Stand der Umsetzung 40 Tage vor der Frist

DATUM
15. April 2021
AUTOR
Alex | Product Manager
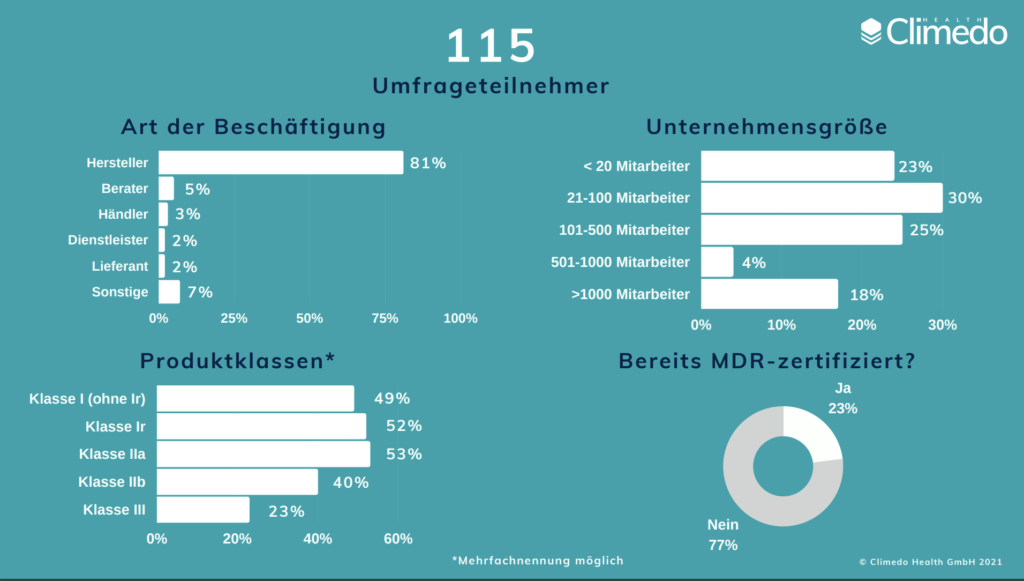
Bis zum neuen EU-MDR-Geltungsbeginn am 26. Mai bleiben nur noch wenige Wochen. Nach unserer ersten Umfrage im Jahr 2020, die kurz vor der Verschiebung des EU-MDR-Termins veröffentlicht wurde, wollten wir herausfinden, wo die Medizinproduktehersteller jetzt in Bezug auf die Umsetzung stehen. Daher haben wir eine zweite Umfrage erstellt, um herauszufinden, ob die Medizinproduktehersteller besser auf die neuen Vorschriften vorbereitet sind, welchen Herausforderungen sie sich weiterhin stellen müssen und ob die zusätzlichen 12 Monate bei der Umsetzung geholfen haben. Die Umfrage lief zwischen März und April und wir sammelten Antworten von 115 Teilnehmern aus ganz Europa, von denen 81 % Medizinproduktehersteller waren. Alle Risikoklassen waren vertreten. 23 % waren bereits MDR-zertifiziert.
EU-MDR-Konformität immer noch eine große Herausforderung
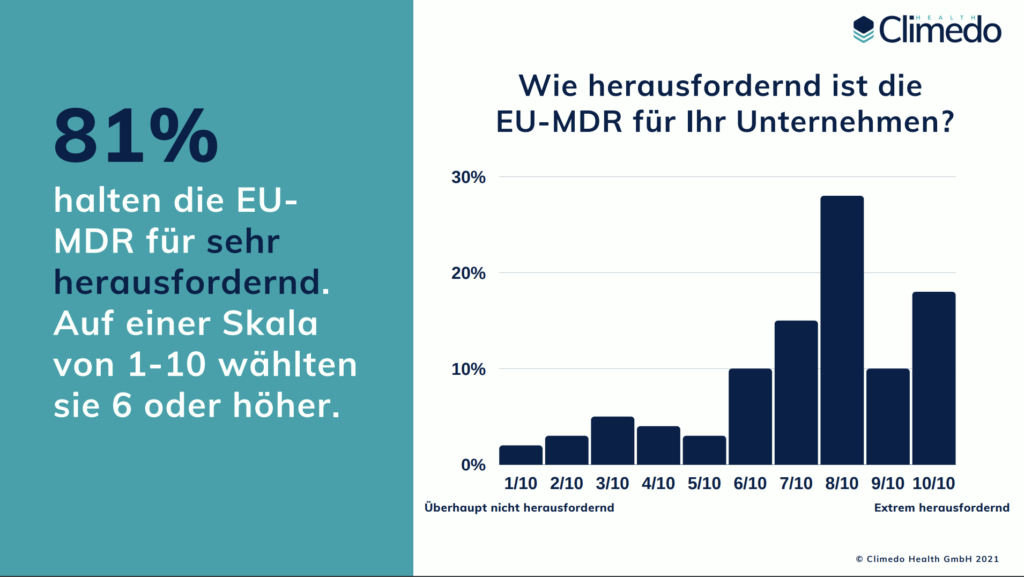
Unsere Umfrage zeigt, dass die Umsetzung der EU-MDR für die meisten Hersteller immer noch eine große Herausforderung darstellt. 81 % der Befragten betrachten die MDR als “sehr herausfordernd”, im Vergleich zu 77 % im Jahr 2020. Die drei größten Herausforderungen, denen sie begegnen, sind erhöhte Ressourcen oder Kosten (70 %), mangelnde Klarheit (59 %) und die erforderlichen klinischen Prüfungen (54 %). Wir haben unsere Teilnehmer auch gefragt, wie viel zusätzliche Kosten sie für ihr Unternehmen aufgrund der neuen Vorschriften erwarten. Ein Drittel (31%) der Befragten schätzte, dass die MDR zusätzliche Kosten zwischen 5 und 10% des Jahresumsatzes verursachen wird, 13% glaubten sogar, dass es mehr als 10% sein könnten. Den Ergebnissen zufolge investieren die meisten Hersteller (64 %) auch mehr als 5 zusätzliche Stunden pro Woche in die Erfüllung der EU-MDR-Anforderungen.
Verschiebung der Frist und Status der Benannten Stellen
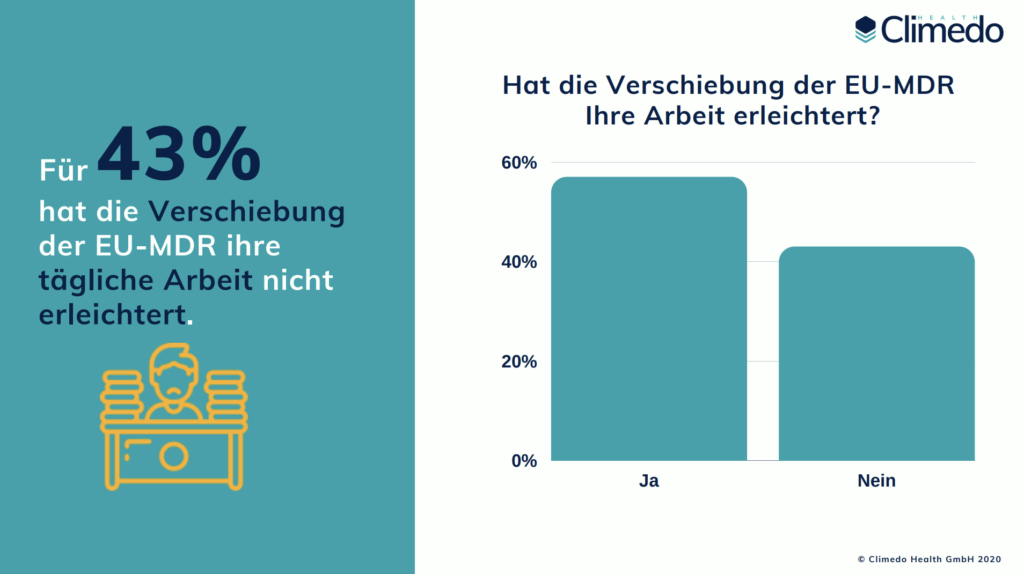
Im April 2020 wurde der Geltungsbeginn der EU-MDR aufgrund der COVID-19-Pandemie um ein Jahr verschoben. Obwohl mehrere Teilnehmer behaupten, dass dies bei der Planung und dem Verständnis der Anforderungen geholfen hat, antworteten dennoch 43 %, dass die Verzögerung ihre tägliche Arbeit nicht erleichtert hat. Sie argumentieren, dass die Verschiebung nur zu einer Verschiebung der Prioritäten geführt hat und die Unklarheit bezüglich der Vorschriften weiterhin besteht. Die Zahl der Hersteller, die eine MDR-zertifizierte benannte Stelle haben, stieg jedoch von 52 % im Jahr 2020 auf 72 %. Für fast 40 % dieser Teilnehmer war es “überhaupt keine Herausforderung”, eine Benannte Stelle zu finden. In Bezug auf virtuelle Audits gaben 61 % an, diese bereits genutzt zu haben oder dies in Zukunft zu planen.
Klinische Datenerfassung
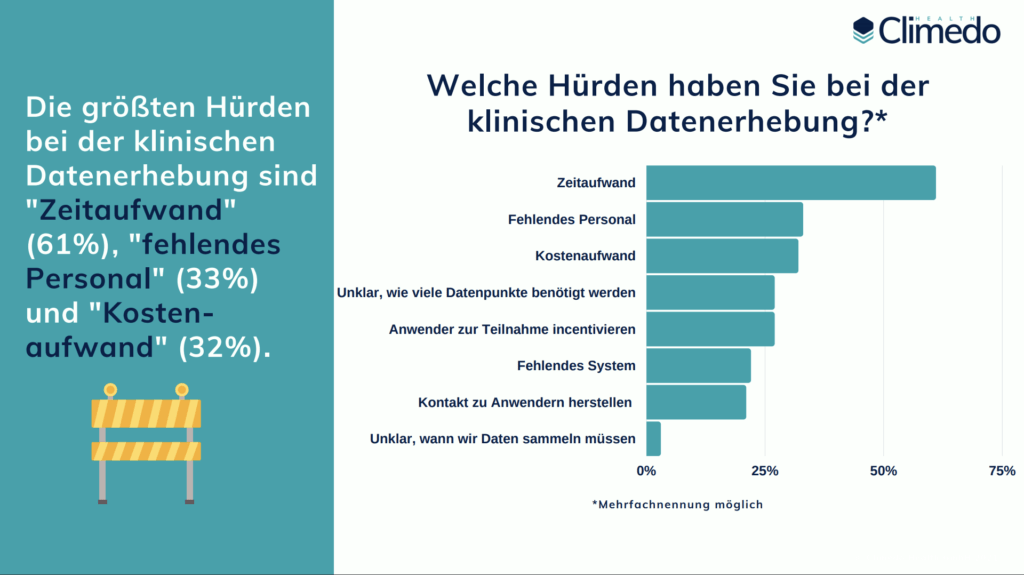
Wenn es um die klinische Datenerfassung geht, setzen 46% noch auf Papier, 61% verwenden Excel-Tabellen. Interessanterweise sieht mehr als die Hälfte aller Umfrageteilnehmer “überhaupt keinen Nutzen” in diesen Lösungen. Lediglich 25 % der Teilnehmer verlassen sich bei der klinischen Datenerfassung auf ein elektronisches Datenerfassungssystem, obwohl 59 % der Befragten EDC-Software als “praktisch in der Anwendung” und 50 % als “zeitsparend” empfinden. Als wir die Teilnehmer nach ihren größten Herausforderungen bei der klinischen Datenerfassung fragten, waren die drei beliebtesten Antworten “Zeitaufwand” (61%), “Personalmangel” (33%) und “hohe Kosten” (32%).
Blick in die Zukunft
Während die EU-MDR sicherlich viele Herausforderungen und Schwierigkeiten für Medizinproduktehersteller mit sich bringt, gibt es auch einige Vorteile. Zum Beispiel wurden “Rückverfolgbarkeit” und “Transparenz” von 43 bzw. 40 % als größte wahrgenommene Vorteile genannt. Allerdings sahen 32 % der Befragten “überhaupt keine Vorteile”. Wir fragten die Teilnehmer auch, was sie sich von der EU-Kommission wünschen würden. Die Ergebnisse zeigten, dass 75 % sich “klarere Richtlinien” wünschen, 50 % “mehr fachliche Unterstützung” und 39 % “Schulungen oder Informationsveranstaltungen”.
Benötigen Sie Unterstützung bei Ihrer MDR-Konformität?
Wie man den Ergebnissen entnehmen kann, stellt die EU-MDR für die meisten Medizinprodukteunternehmen weiterhin eine große Herausforderung dar. Wenn Sie Unterstützung bei der Digitalisierung Ihrer klinischen Datenprozesse benötigen, um wertvolle Zeit zu sparen, vereinbaren Sie eine unverbindliche Software-Demo mit uns!
Weiterführende Inhalte
- Der BVMed berichtet über unsere Umfrageergebnisse
- Umfrage zu den wahren Kosten der EU-MDR