Infografik: 5 Schritte zur Vorbereitung auf die EU-MDR

DATUM
14. August 2019
AUTOR
Veronika | Co-Founder & COO
Im Mai 2017 wurde in der Europäischen Union eine neue Medizinprodukteverordnung (EU-MDR / Medical Device Regulation) eingeführt. Ziel dieser Verordnung ist es, die Sicherheit und Wirksamkeit von Medizinprodukten gründlicher und proaktiver zu validieren. Die Folge: Medizinproduktehersteller müssen den Nachweis eines konsistenten und proaktiven Prozesses zur Dokumentation ihrer klinischen Forschungsaktivitäten vor und nach dem Markteintritt für Medizinprodukte aller Klassen erbringen.
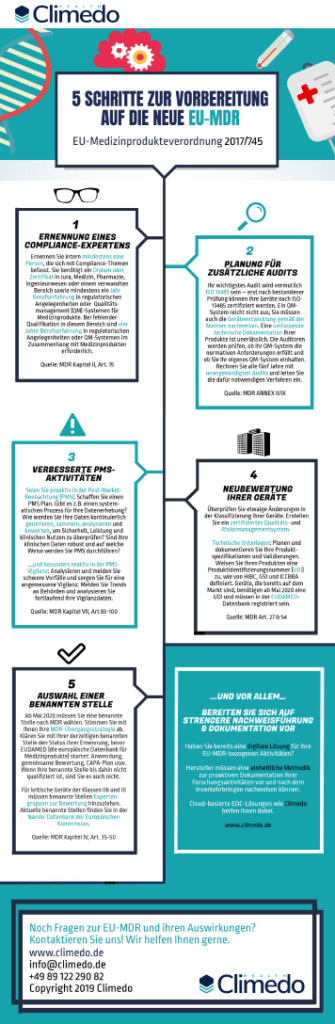
Doch viele Hersteller fühlen sich noch von den Anforderungen der EU-MDR überfordert. Unsere Infografik bietet Ihnen fünf praktische Schritte zur Vorbereitung Ihrer internen Prozesse auf die neue Medizinprodukteverordnung. Wir befassen und mit fünf Kernbereichen, die Sie unbedingt überprüfen sollten, um zu vermeiden, dass Ihre Geräte vom Markt genommen werden.
Diese Bereiche sollten für Ihre MDR-Konformität unbedingt beachtet werden
- Ernennung eines Experten für regulatorische Compliance in Ihrem Unternehmen
- Planung für strengere, unangekündigte Audits
- Verbesserung Ihrer PMS-Aktivitäten (einschließlich proaktiver PMS-Planung und reaktiver PMS-Vigilanz)
- Neubewertung Ihrer Geräte im Hinblick auf technische Unterlagen und UDIs
- Auswahl einer geeigneten Benannten Stelle („Notified Body“) vor Beginn von EUDAMED (im Mai 2022)
Vor allem aber sollten Sie auch eine digitale, standardisierte Lösung für Ihre EU-MDR-bezogenen Aktivitäten haben. Sollten Sie Unterstützung bei der automatisierten und effizienten Post-Market-Überwachung Ihrer Medizinprodukte benötigen, kontaktieren Sie uns jederzeit oder vereinbaren Sie eine persönliche, unverbindliche Demo unserer Software.
Falls Sie die gesamte MDR-Verordnung ansehen möchten, gibt es hier das Dokument in voller Länge (175 Seiten).
Weitere EU-MDR-Inhalte zum Download
Whitepaper: PMS in der EU-MDR-Ära meistern
Playbook: Wie die EU-MDR die Zukunft der MedTech-Branche prägen wird