Erfolgsfaktoren für klinische Studien – das waren unsere Webinar-Highlights

DATUM
15. Dezember 2020
AUTOR
Kristina Weber | Product Lead
Webinar mit Auto Tissue Berlin über elektronische Datenerhebung (EDC)
Letzte Woche fand unser drittes und letztes Webinar in diesem Jahr statt. Mit dabei war neben Veronika Schweighart diesmal auch Prof. Dr. Christoph Schmitz von Auto Tissue Berlin, einem zertifizierter Hersteller, der sich auf die Entwicklung und Herstellung zellfreier biologischer Implantate spezialisiert hat. Darüber hinaus bietet das Unternehmen auch Auftragsentwicklung und -fertigung biologischer Implantate an.
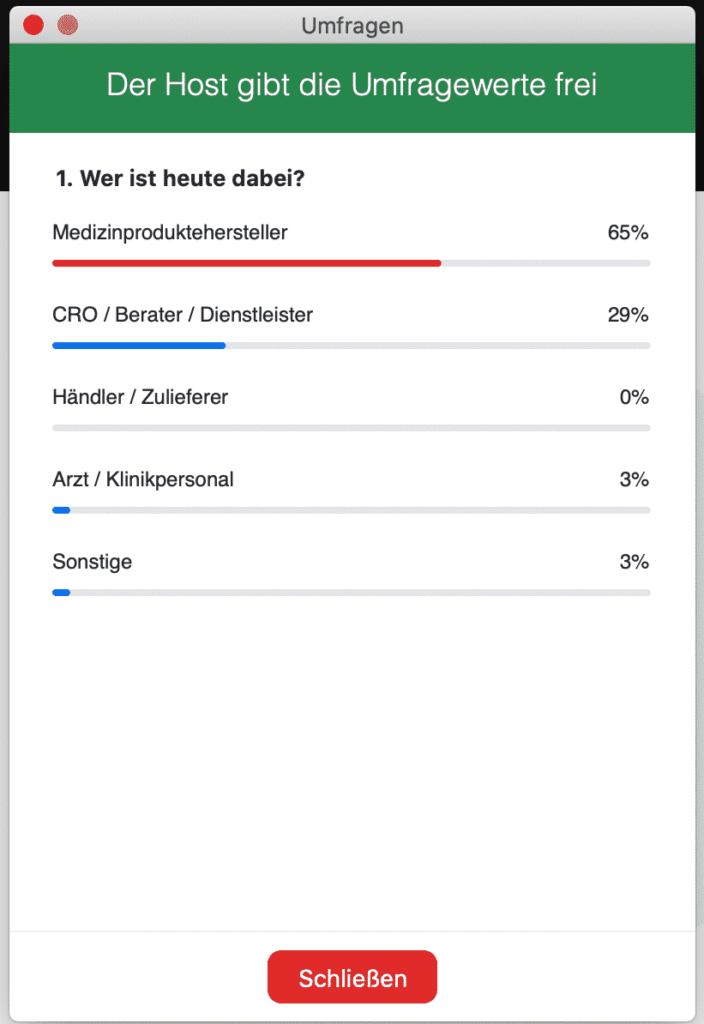
Nachdem die rund 40 Teilnehmer sich in die Session eingewählt hatten, starteten wir auch gleich mit unserer ersten Live-Umfrage, um zu sehen, welche Branchen bzw. Rollen vertreten waren: Fast zwei Drittel stammten von Medizinprodukteherstellern, während 29% für CROs, Berater oder Dienstleister arbeiteten und 3% als Arzt oder Klinikpersonal tätig waren.
Als nächstes wurden die beiden Unternehmen Auto Tissue Berlin und Climedo Health, die seit Mitte 2020 ein gemeinsames Projekt haben, näher vorgestellt.
Aktuelle Herausforderungen für Medizintechnik-Unternehmen
Im ersten Hauptteil des Webinars wollten wir erkunden, mit welchen Herausforderungen sich MedTech-Unternehmen wie Auto Tissue Berlin aktuell konfrontiert sehen. Vorab wurden aber zunächst noch die Herausforderungen des Publikums abgefragt.
Eine ähnliche Frage hatten wir vor einigen Monaten im Rahmen unserer EU-MDR-Umfrage über die wahren Kosten der neuen Verordnung gestellt. Die Ergebnisse finden Sie hier zum Download. In beiden Fällen waren Mehrfachnennungen möglich.
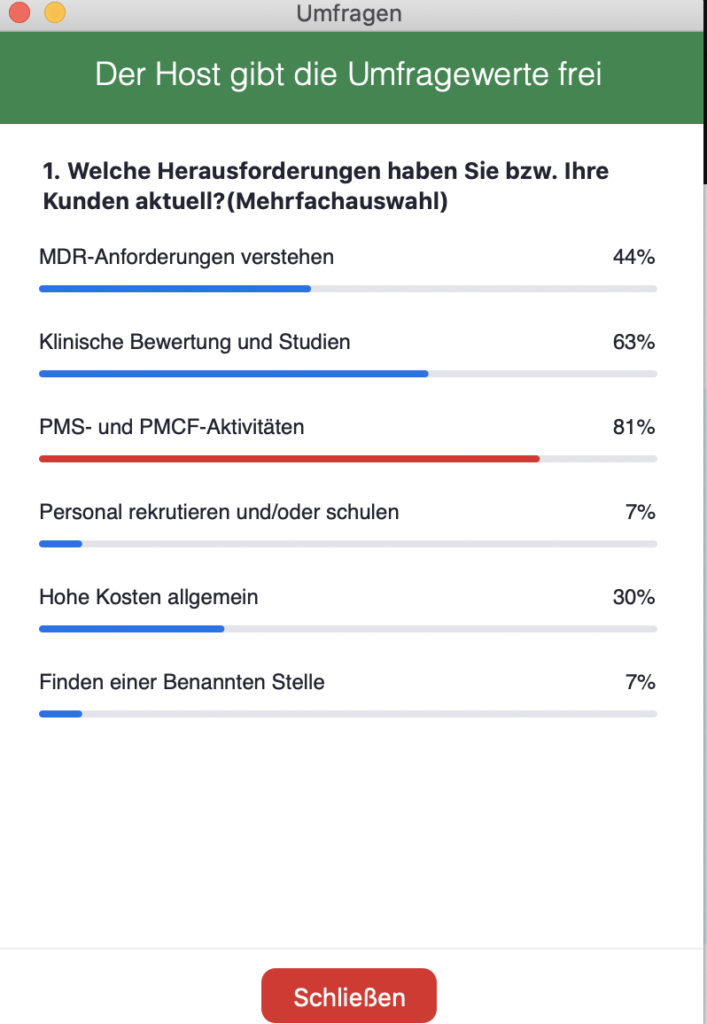
Die Ergebnisse der Live-Umfrage zeigten, dass momentan besonders PMS und PMCF, also die Überwachung nach dem Inverkehrbringen für Hersteller sehr schwieriger sind; diese wurden von 81% der Teilnehmer genannt. An zweiter Stelle standen klinische Bewertungen und klinische Studien mit 63%. Das Verständnis der EU-MDR-Anforderungen wurde am dritthäufigsten genannt (44%), gefolgt von den allgemeinen hohen Kosten (30%) sowie das Finden einer Benannten Stelle und die Personalsuche mit je 7%.
An dieser Stelle schilderte Christoph Schmitz auch seine eigene Erfahrung bei Auto Tissue Berlin. Er bestätigte, dass man heute ohne klinische Daten im Rahmen von Studien und PMS/PMCF kein Produkt mehr rezertifiziert bekomme, selbst wenn es seit Jahrzehnten auf dem Markt ist. Aktuelle klinische Daten müssen vorgelegt werden, um eine Rezertifizierung zu bekommen.
Zum Thema Verständnis der Anforderungen erging es ihm ähnlich. Die EU-MDR als langes Dokument mit vielen Verweisen auf andere lange Dokumente sei eine sehr mühsames und zeitintensive Angelegenheit, was wiederum Kosten verursacht.
Bei der Rekrutierung des Personals hatte Auto Tissue Berlin wiederum keine Schwierigkeiten, aber die Abteilung wurde im Zuge der EU-MDR von der Größe her verdreifacht.
Hinsichtlich der Benannten Stellen hatte das Unternehmen Glück: Der TÜV Rheinland hat die Zulassung für den Bereich von Auto Tissue Berlin behalten. Es hätte natürlich auch passieren können, dass die Benannte Stelle – wie viele andere – wegfällt, während die übriggebliebenen teilweise bestimmte Bereiche verloren haben. Als Firma mit einem Nischenprodukt hätte es für Auto Tissue Berlin auch anders ausgehen kann.
Als nächstes sprachen Christoph Schmitz und Veronika Schweighart über konkrete Herausforderungen von Auto Tissue Berlin. Hierbei standen folgende Fragen im Vordergrund:
Welche (zusätzlichen) Herausforderungen hat Auto Tissue Berlin als Klasse-III-Hersteller und hinsichtlich klinischer Studien?
- EU-MDR-Anforderungen sind teilweise sehr abstrakt formuliert; die FDA stellt vergleichsweise deutlich klarere Forderungen
- Klinische Daten müssen jetzt auch für ältere, erfolgreiche Produkte im Markt ständig neu erhoben werden, wofür auch neue klinische Studien erforderlich sein werden; als Klasse-III-Hersteller bedeutet das für Auto Tissue Berlin, dass sie die klinische Bewertung und Risikobewertung jedes Jahr aktualisieren. Somit müssen sie jedes Jahr neue Daten bekommen und damit wird die Möglichkeit, Daten einfach zu erhalten immer wichtiger
Wie wurden klinische Daten vor Climedo erhoben?
- Kunden haben Excel-Tabellen erhalten mit Spalten zu den Punkten, die den Hersteller interessiert haben. So hatte man die Daten also schon mal “digital” vorliegen, aber es gab keine Validierung während der Eingabe und keine Pflichtfelder. Wichtige Felder wurden damit oft übersehen und man musste bei den Leuten nochmal nachfassen, um wichtige Informationen zu bekommen
- Das Hauptproblem bei all diesen Formen sei, dass man z.B. 20 Seiten Fragen hat, aber eigentlich nur auf Seiten 13, 17 und 19 in einem Feld eine Zahl eintragen müsse, was die ganze Sache knifflig macht. Mit modernen Systemen wie Climedo, können die Fragen in einer Art Interview-Format gestellt werden und deutlich besser abgebildet werden als in einem Excel-Sheet
Digitale Lösungen: Der Weg zur elektronischen Datenerfassung
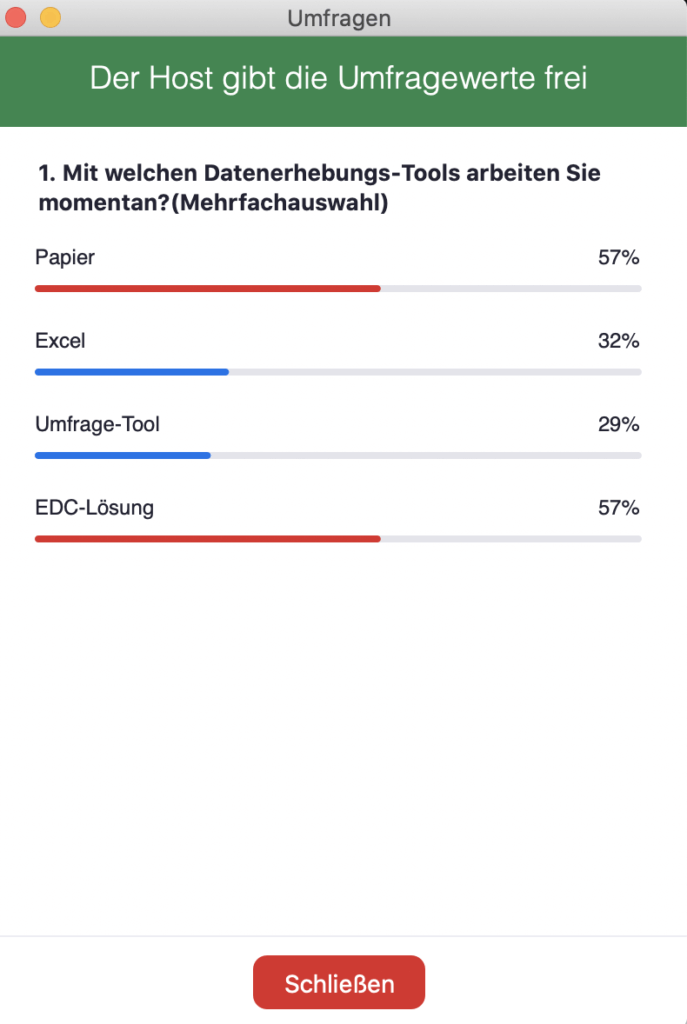
Im zweiten Block fragten wir zunächst unsere Teilnehmer, mit welchen Tools zur klinischen Datenerhebung sie momentan arbeiten.
Interessanterweise zeigten die Ergebnisse, dass mehr als die Hälfte der Teilnehmer (57%) mit Papier und / oder EDC-Lösungen („Electronic Data Capture“) arbeiteten. Wie im Webinar angesprochen wurde, nutzen viele Unternehmen eine Kombination, je nach Studiengröße und -komplexität. Rund ein Drittel (32%) arbeiteten mit Excel-Tabellen, während 29% mit einem Umfragetool arbeiteten.
Infografik: Klinische Studien papierlos durchführen
Laut Christoph Schmitz glauben viele Hersteller, dass sich der Aufwand für ein EDC-System für kleine Studien gar nicht lohnt, sondern dass Papier und Excel. Jedoch hat er durch Climedo gelernt, dass dem nicht so ist. Auch wir sind der Meinung, dass manuelle Systeme wie Papier oder Excel mit der EU-MDR kaum noch mithalten werden können.
Spectaris-Beitrag (S. 50): Mit digitalen Lösungen zur EU-MDR-Konformität
Als nächstes wurden die wichtigsten Anforderungen in Bezug auf EDC besprochen.
Was muss ein gutes EDC-Tool mitbringen und warum?
- Es sollte ein System sein, dass man als Arzt – und nicht Programmierer – relativ einfach und selbständig aufsetzen kann. Das bedeutet einerseits, dass es schneller geht und andererseits, dass die Sache kostengünstiger ist
- Das Kostenmodell sollte transparent sein, was Auto Tissue Berlin auch bei Climedo besonders gut gefallen hat. Dies sei besonders bei einem Registry von Vorteil, da man hier nicht weiß, was zurückkommt und man man schließt dann teilweise Kliniken ein, die nichts bringen. Dies kann sehr schnell sehr teuer werden, ohne dass man Daten zurückbekommt. Bei Climedo hat ihm gefallen, dass man nicht für jeden Nutzer zahlt, sondern nur pro Studie / Umfrage.
- Das System muss auf modernen Web-Browsern abgerufen werden und zwar unabhängig vom Endgerät. Es muss genauso gut auf einem Smartphone funktionieren wie auf einem großen Bildschirm.
- Das Ganze muss sicher sein. Die Datenerhebung und – speicherung bringt teilweise große rechtliche Probleme mit sich. Deswegen muss man sich darauf verlassen können, dass das System, mit dem man arbeitet, die aktuellen Anforderungen erfüllt und zwar ohne, dass sich der Kunde selbst darum kümmern muss.
Wie hat Climedo hierbei geholfen?
- Christoph Schmitz hat damals zuerst ein zweistündiges Online-Training erhalten, um mit dem Climedo-Tool vertraut zu werden. Am selben Abend hatte er die CRFs von einer Papierstudie von Auto Tissue Berlin bereits in Climedos System übernommen.
- Die Benutzeroberfläche war ansprechend und es hat auch Spaß gemacht, mit Climedo zu arbeiten und zu experimentieren.
- Es war sehr einfach, die Informationen hinterher zu verteilen. Beispielsweise hat Christoph Schmitz einigen Kollegen Links geschickt, damit sie sich gleich ansehen konnten, was er erstellt hatte. So konnten sie direkt ausprobieren, wie es funktioniert.
- Die Automatisierung sei wirklich “fantastisch”, was lang- und mittelfristig dazu beitragen werde, dass Auto Tissue Berlin Kosten sparen kann. Dies sei auch einer der Knackpunkte von einem EDC-System: Man muss zunächst eine gewisse Investition erbringen, um das ganze aufzusetzen, aber hinterher soll man auch Zeit einsparen können. Der Arbeitsaufwand vom Endanwender bzw. Kliniker sollte auf die Person übertragen werden, der die eCRFs aufsetzt. Denn das Ausfüllen von Formularen hat in den letzten Jahren stark zugenommen und man muss versuchen, dem Endnutzer das Leben so einfach wie möglich zu machen
- Zuletzt hat es auch wirklich Spaß gemacht, vom Climedo-Team in das Produkt eingeführt zu werden und das Unternehmen konnte zudem Sicherheit “made in Germany” garantieren
Wofür wird Climedo heute genutzt und was ist der aktuelle Stand?
- Durch COVID-19 ist die Zusammenarbeit mit Kliniken deutlich erschwert worden und die Dinge haben etwas länger gedauert als geplant. Dennoch ist die Studie mittlerweile bei den ersten Ethik-Kommissionen durch.
- Die Studie ist relativ überschaubar: Es sollen 100 Patienten in fünf Zentren in Europa aufgenommen werden. Der primäre Endpunkt beträgt sechs Monate, aber die Patienten sollten nach der Operation über einen Zeitraum von ein bis fünf Jahren automatisch vom Climedo-System angeschrieben werden und einen kleinen Bogen zu ihrem Gesundheitszustand ausfüllen
- Zudem ist eine Registry mit Climedos eSurvey-Lösung geplant. Mit dieser Lösung wird dem Endanwender möglichst viel Arbeit abgenommen
Live-Demo
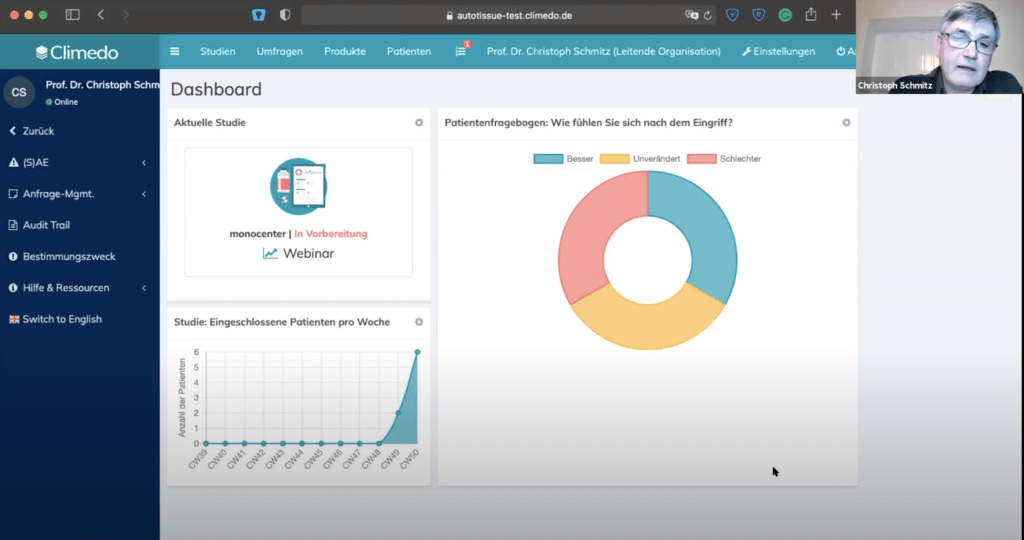
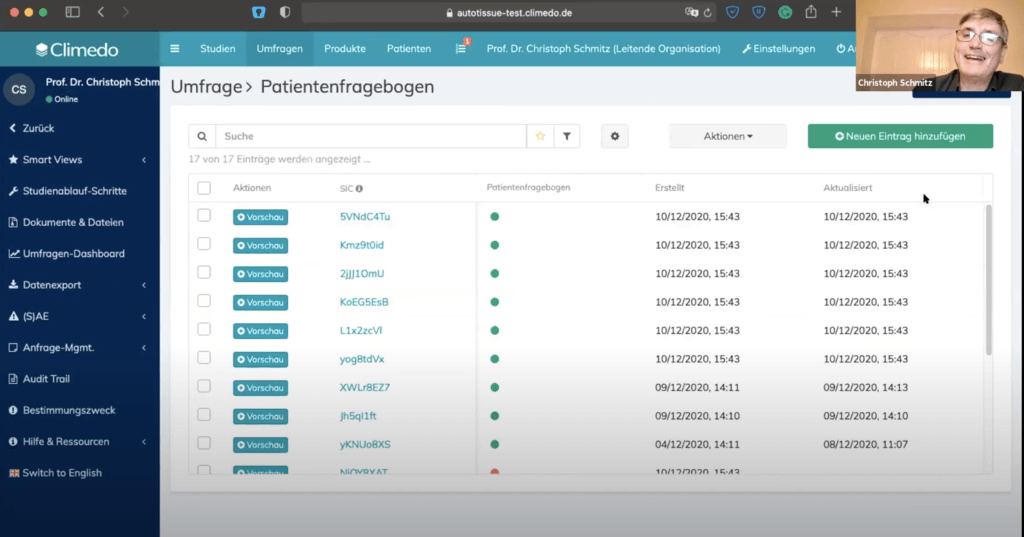
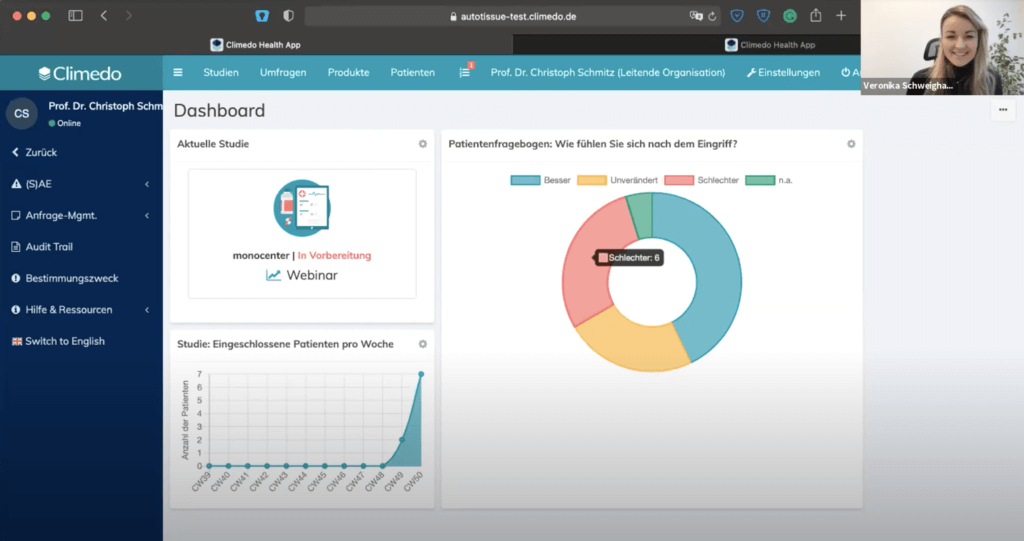
Im dritten Teil stellte Christoph Schmitz das Climedo-System in einer Testinstanz vor. Zuerst zeigte er unseren Teilnehmern die anpassbare Dashboard. Hier war unter anderem ein Link zur Studie enthalten und man konnte die Anzahl der aufgenommenen Patienten sehen. Man kann aber auch einzelne Fragen statistisch anzeigen lassen, z.B. einen Patientenfragebogen mit Prozentsätzen der Antworten.
Dann ging es weiter mit der Studie. Hier sieht man in der Übersicht die bislang eingeschlossenen Patienten als Liste sowie Informationen dazu, welche eCRFs bereits ausgefüllt wurden – basierend auf einem Ampelsystem.
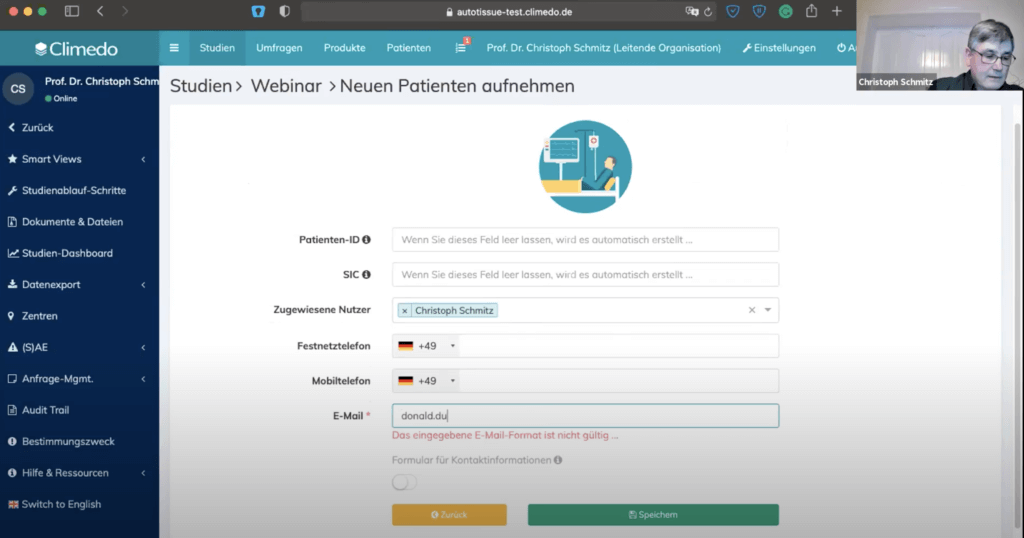
Als nächstes zeigte Christoph Schmitz, wie Patienten aufgenommen werden – hierfür braucht man lediglich eine E-Mail-Adresse. Die Patienten-ID und SIC werden automatisch vom System generiert.
Hier kann die Klinik auch Patientendaten hinterlegen bzw. danach suchen, was enorm wichtig ist.
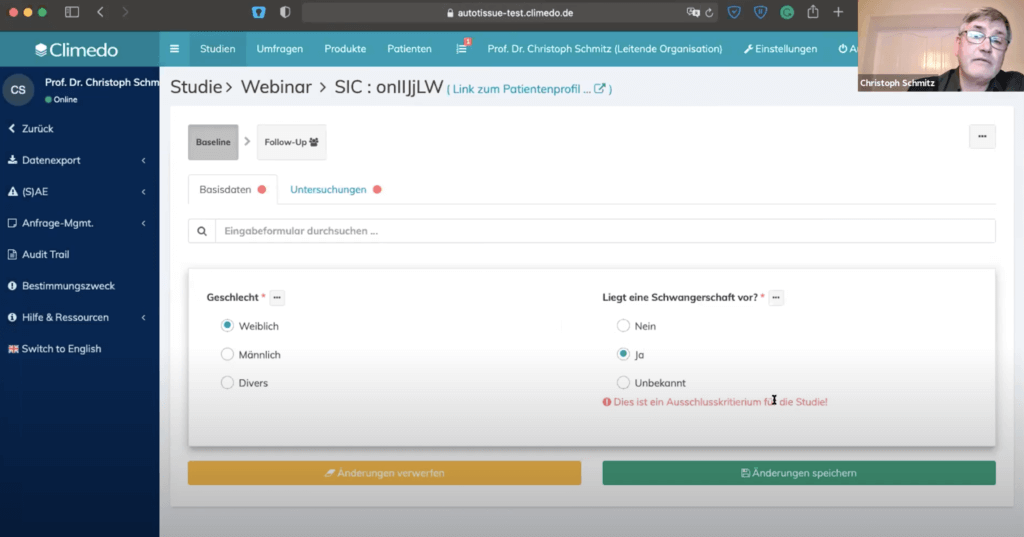
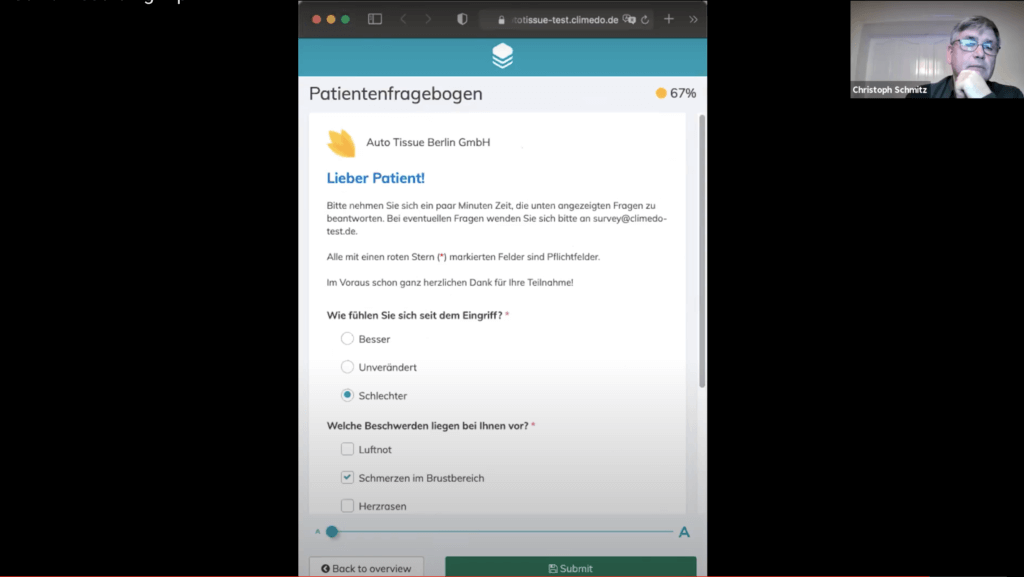
Danach haben wir uns angesehen, wie die Studienfragen im Detail erscheinen. Mit Abhängigkeiten (“Dependencies”) kann zum Beispiel festgelegt werden, ob auf eine bestimmte Antwort hin eine neue Frage erscheint. Wenn man etwa angibt dass der Patient weiblich ist, wird sofort nach der Schwangerschaft gefragt.
So können beispielsweise frühzeitig bestimmte Ausschlusskriterien für die Studie festgelegt werden. Innerhalb eines Studienschritts können zudem unterschiedliche Reiterstrukturen in das System gebracht werden. Die Abhängigkeiten kann auch auf Reiterbene vorgenommen werden. So kann mit einem ganz einfachen Feld – ohne den um Informationen zu bitten, die er hinterher nicht geben muss – steuern.
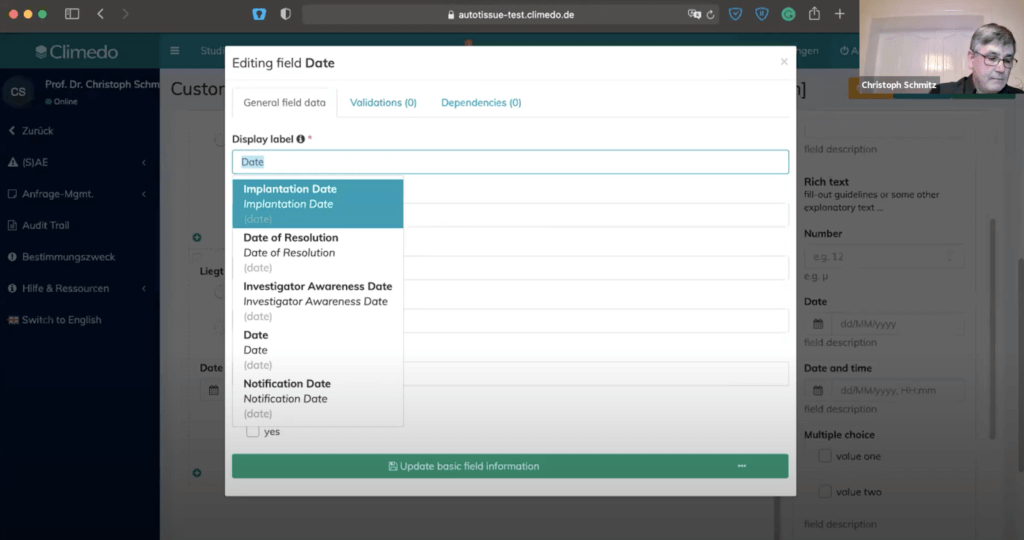
In den Tab Templates sahen wir uns als nächstes an, wie Fragebögen erstellt werden können. Hierfür bietet Climedo verschiedenste Bausteine, wie etwa Textfelder, Zahlen, Datumsfelder, Uhrzeiten, Multiple Choice Fragen etc, die per Drag & Drop ins Formular gezogen werden können. Auch Dependencies können hier konfiguriert werden.
Im Preview-Modus kann anschließend alles getestet werden.
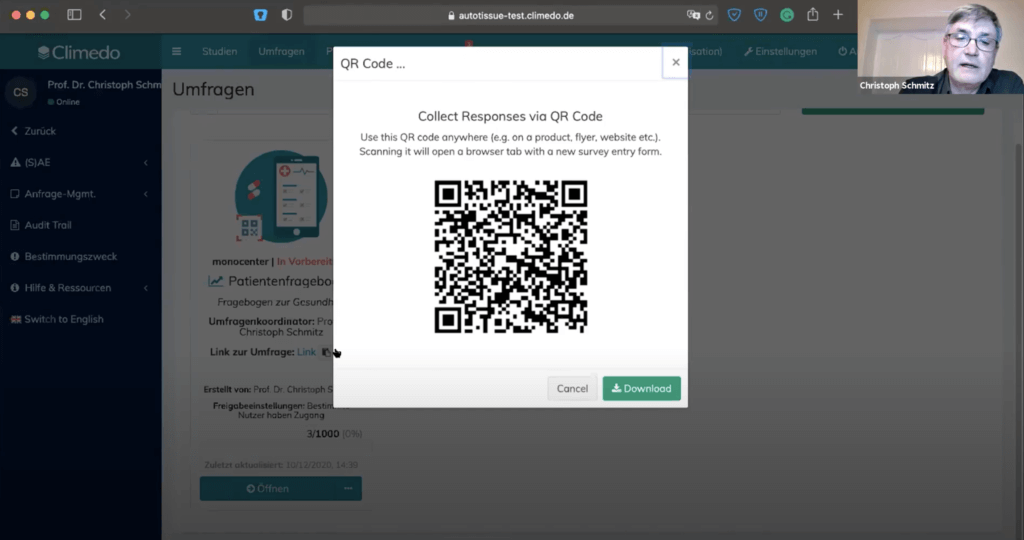
Um die Test-Umfrage im Climedo dann auch den Teilnehmern vorzuführen, wurde danach ein QR-Code angezeigt, den man vom Smartphone aus abscannen konnte.
Die ausgefüllten Fragebögen wurden in Echtzeit im in der Umfrageübersicht angezeigt.
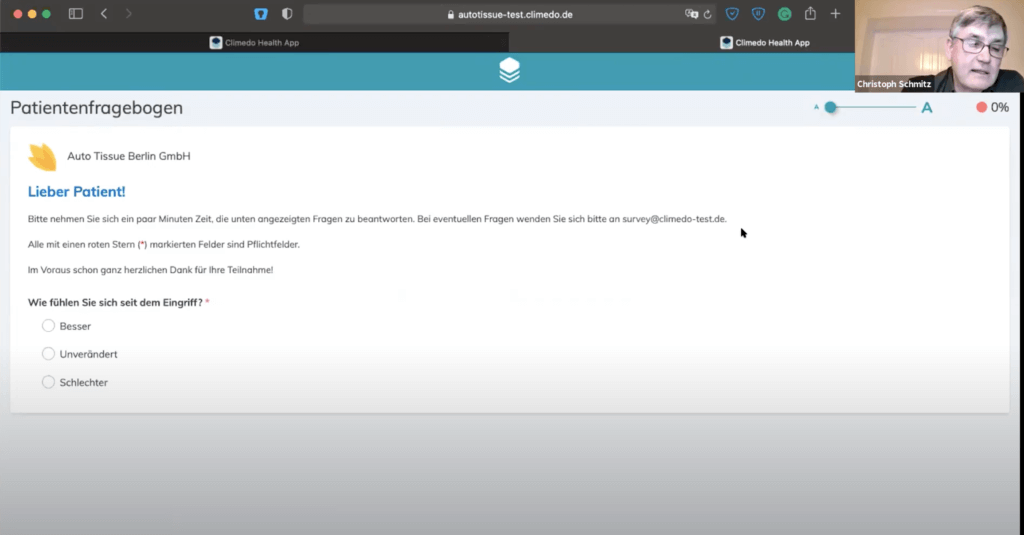
Aus Patientensicht sah der Fragebogen wie folgt aus:
Wenn man solche Umfragen mit Papierbögen macht, hat man man die Information erst zu dem Zeitpunkt, an dem der Papierbogen bei einem angekommen ist. Mit Climedo passiert dies zeitlich mit dem Moment, in dem sie ins System eingetragen werden. Diese “responsiven” Fragebögen werden auch auf jedem Endgerät korrekt dargestellt.
Auch in der Dashboard-Ansicht wurden die neuen Daten bereits widergespiegelt.
Fazit
Damit waren wir bereits beim Fazit angekommen. Hier wurde nochmal hervorgehoben, dass die EU-MDR erhebliche Kosten und Ressourcens seits der Hersteller fordert und vor allem klinische Studien und Bewertungen zu den größten Herausforderungen zählen. Gleichzeitig können digitale Lösungen wie Climedo jedoch helfen, wertvolle Zeit und damit auch Kosten einzusparen. Mit einer guten Benutzeroberfläche und responsiven Übersichten ist dies auch für die Nutzerbindung und die Compliance von großem Vorteil.
Wir stehen schon fleißig in der Planung für unsere nächsten Webinare im Frühjahr 2021. Bis dahin finden Sie die vollständigen Folien hier.
Falls auch Sie die Climedo-Software näher kennenlernen möchten, können Sie sich hier für einen kostenfreien Testzugang registrieren: