IVDR-Umfrageergebnisse: Auf welchem Stand der Umsetzung sind die Hersteller?

DATUM
28. April 2022
AUTOR
Catherine | Associate Director Marketing
Die Übergangsfrist endet bald: Ab dem 26. Mai 2022 wird die neue Europäische Verordnung für In-vitro-Diagnostika (IVDR) schrittweise gültig. Im März 2022 haben wir daher gemeinsam mit TRIGA-S insgesamt 45 IVD-Hersteller– darunter 30 Unternehmen aus Deutschland, 8 aus anderen EU-Ländern und 7 von außerhalb der EU – dazu befragt, wie sie mit der Umsetzung der neuen Richtlinien bislang zurechtkommen. Bei mehr als der Hälfte der Teilnehmenden handelt es sich um kleinere Firmen mit weniger als 50 Mitarbeitenden. Diese führen Produkte aus allen Risikoklassen, besonders jedoch A (nicht-steril), B und C mit jeweils 27%. Lediglich sechs Unternehmen (13%) hatten ihre Produkte bereits nach IVDR CE-zertifiziert.
In diesem Beitrag stellen wir Ihnen die wichtigsten Erkenntnisse aus unserer IVDR-Umfrage 2022 vor. Zu den vollständigen Ergebnissen geht es hier.
Die zentralen Ergebnisse der IVDR-Umfrage 2022
1. Die Top 3 Hürden: Timelines, Leistungs- und Post-Market-Anforderungen
2. Die Vorbereitungen sind noch in vollem Gange
3. Ein Großteil der IVD-Hersteller zieht externe Unterstützung hinzu
4. Der größte Vorteil der IVDR: Patientensicherheit
1) Die Top 3 Hürden: Timelines, Leistungs- und Post-Market-Anforderungen
Laut eigener Einschätzung sind den meisten IVD-Hersteller die Anforderungen und Verantwortlichkeiten der IVDR sehr gut (27%) oder gut (60%) bekannt. Mit 32% der Stimmen fühlen sich die Teilnehmenden am besten mit der Norm EN ISO 13485 vertraut, dicht gefolgt von den MDCG-Guidelines (21%). Die gesamten Anforderungen hinsichtlich der Post Market Surveillance und Überwachung der Produkte am Markt kennen dagegen bereits rund zwei Drittel (65%) der Befragten.
Mit 30 der 45 Teilnehmenden nannte eine große Mehrheit die Übergangsfristen der IVDR als Herausforderung. Somit werden die Timelines (27%) eindeutig als größte Hürde empfunden. Auf den Plätzen zwei bis vier finden sich die Leistungsanforderungen (16%), Post-Market-Anforderungen (14%) und das Finden Benannter Stellen (12%) eng beisammen. Lediglich ein:e einzige:r Befragte:r sieht keine nennenswerten Herausforderungen.
2) Die Vorbereitungen sind noch in vollem Gange
Trotz der größtenteils bekannten Anforderungen in Bezug auf die neue Verordnung hat die Umfrage gezeigt, dass sich 85% der befragten Hersteller auch wenige Wochen vor Geltungsbeginn noch mitten in den Vorbereitungen befinden. Ganze 11% haben sogar noch nicht einmal damit begonnen. Am weitesten waren die Teilnehmenden diesbezüglich mit der Definition der Zweckbestimmung und der Produktspezifikationen, die zu 18% bzw. 15% abgeschlossen sind. Der Performance Evaluation Report ist dagegen bisher nur zu 5% finalisiert.
Allerdings haben immerhin bereits 27 Teilnehmende (60%) eine verantwortliche Person für die Einhaltung der regulatorischen Vorschriften („Person Responsible for Regulatory Compliance“, kurz PRRC) benannt. Mit der Registrierung der Produkte in der EUDAMED-Datenbank („European Database on Medical Devices“) haben 58% der Befragten dagegen noch nicht einmal begonnen, während 36% derzeit damit beschäftigt sind. Auch über eine Benannte Stelle für die Zertifizierung der Produkte verfügt erst rund die Hälfte der Befragten.

3) Ein Großteil zieht externe Unterstützung hinzu
Ein Grund für das teilweise schleppende Vorankommen lässt sich in fehlenden Ressourcen ausmachen: Mit je 28% sind Zeit und Personal die beiden größten Faktoren, die Hersteller zur Vorbereitung auf die Einführung der IVDR zusätzlich benötigen. Der Bedarf an weiterer regulatorischer Beratung fällt mit nur rund 6% dagegen relativ gering aus. Insgesamt greifen immerhin 61% der Befragten bei der Erfüllung der IVDR auf Hilfe durch Dienstleister zurück, darunter hauptsächlich Prüflabore (22%). CROs, Legal Manufacturers und Dienstleister für Patentschutz unterstützen die Teilnehmenden dagegen nur zu jeweils 10%.
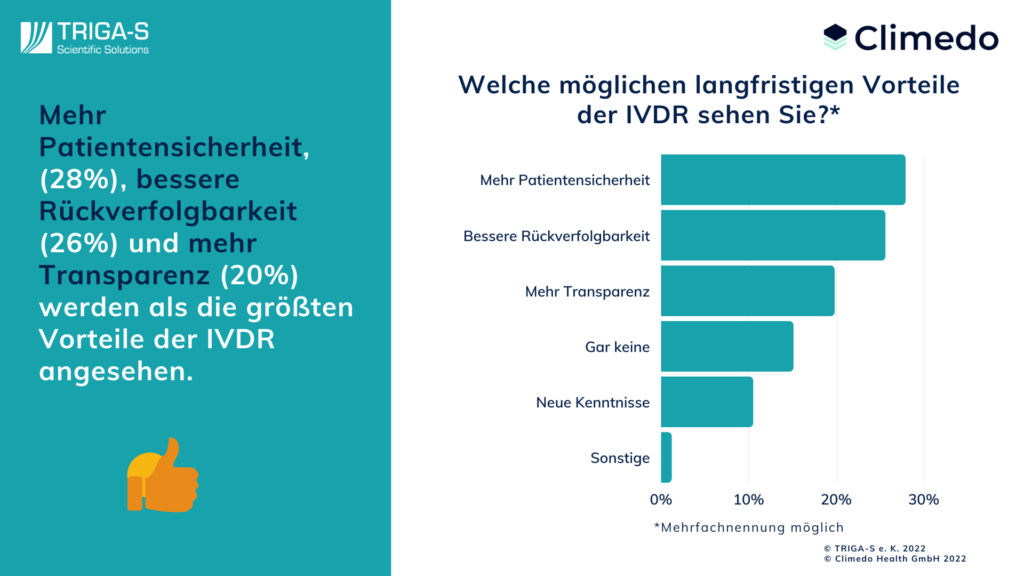
4) Der größte Vorteil der IVDR: Patientensicherheit
Bei all diesen Hürden und Mehraufwand, den die Umstellung auf die IVDR mit sich bringt, dürfen wir jedoch die Vorteile dieser Neuerung nicht aus den Augen verlieren. Daher wollten wir von den Befragten auch wissen, welche langfristigen Vorteile sie in der IVDR sehen. Auf Platz eins führen Hersteller mit 28% die größere Patientensicherheit an, dicht gefolgt von der besseren Rückverfolgbarkeit (26%) und der höheren Transparenz (20%). Auch der Gewinn neuer Erkenntnisse ist zu immerhin 11% vertreten. Nur 13 Befragte sehen keinerlei Vorteile der neuen Verordnung, was etwa 15% der Antworten entspricht.
Fazit: IVDR als Startpunkt zur Digitalisierung
Aus den Umfrageergebnissen wird deutlich, dass die IVDR für IVD-Hersteller viele Herausforderungen, aber auch Chancen bereithält. Dabei ist ein Großteil auch kurz vor Geltungsbeginn noch damit beschäftigt, die neuen Vorgaben umzusetzen, in vielen Fällen mit Unterstützung durch entsprechende Dienstleister. In den vergangenen beiden Jahren brachte zudem die COVID-19-Pandemie die Vorbereitungen von immerhin 36% der Befragten ins Stocken; nur zwei Befragte (4%) verzeichneten einen positiven Einfluss.
Fast die Hälfte der Befragten (47%) verwendet Excel zur Erhebung ihrer klinischen Daten und rund ein Fünftel (21%) greift sogar noch auf Papier zurück. Beide Methoden sind jedoch fehleranfällig und können sich dadurch negativ auf die Datenqualität auswirken. Von einer zeitnahen Umstellung auf EDC-Lösungen („Electronic Data Capture“) können Hersteller daher nur profitieren. Automatisierte und webbasierte Datenerhebungstools machen den gesamten Prozess der Validierung und der Überwachung der IVD nach dem Inverkehrbringen sicherer. Zusätzlich sparen sie viel Zeit und Personal ein – zwei wichtige Ressourcen, wie unsere Umfrage zeigt.
Als Spezialist für elektronische Datenerhebung unterstützen wir Sie gerne bei der Umstellung auf EDC. Sprechen Sie uns an oder vereinbaren Sie eine unverbindliche Software-Demo!
Die vollständigen IVDR-Umfrageergebnisse gibt es hier zum Download.