MedTech Connect, die Zweite: Klinische Studien in der Post-Market Phase

DATUM
27. Mai 2021
AUTOR
Sascha | Co-Founder & CEO
Vor kurzem fand bereits unser zweites #MedTechConnect Event statt und wir haben uns unheimlich gefreut, erneut eine Vielzahl an Teilnehmern aus der Medizintechnik-Branche in unserem Online-Meetup begrüßen zu dürfen. Rund 80 Gäste hörten sich den spannenden Vortrag von Dr. Andrea Röthler zum Thema “PMCF” (“Post-Market Clinical Follow-up” / Klinische Nachbeobachtung) an und stellten im Anschluss zahlreiche Fragen an die Referentin.
Worum ging’s?
Wie sollten PMCF-Studien idealerweise aussehen? Unter welchen Voraussetzungen müssen Hersteller PMCF-Studien durchführen? Wie führen Sie diese Art von Studien durch die Beachtung einfacher Grundregeln zum Erfolg?
Diese und weitere Fragen stellen sich zahlreiche Medizinproduktehersteller, egal ob sie freiwillig PMCF-Aktivitäten ergreifen wollen oder durch die EU-Medizinprodukteverordnung (EU-MDR) dazu verpflichtet sind. Aus diesem Grund wollten wir sie bei MedTech Connect näher unter die Lupe nehmen.
Wer waren die Referenten?
Amelie Fink, Account Managerin bei Climedo Health, übernahm die Moderation des Events und leitete im Anschluss an den Vortrag von Dr. Andrea Röthler die Fragen- und Diskussionsrunde.
Mit zu Gast war auch Dr. Andrea Röthler, Head of Project Management bei GKM Gesellschaft für Therapieforschung mbH – einem renommierten Auftragsforschungsinstitut. Sie verfügt über 18 Jahre Erfahrung im Projektmanagement klinischer Prüfungen mit Arzneimitteln und Medizinprodukten. Ihre Schwerpunkte umfassen zudem NIS-Studien bzw. PMCF-Studien, Monitoring sowie Regulatory Affairs für Medizinprodukte.
Wer waren die Teilnehmer?
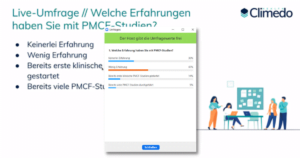
Nach einem kurzen Intro startete direkt unsere erste Live-Umfrage, um herauszufinden, wie viel Vorerfahrung die Teilnehmer schon in Bezug auf PMCF-Studien hatten. Fast die Hälfte (47%) gab an, nur “wenig Erfahrung” mit PMCF-Studien zu haben, gefolgt von fast einem Drittel (30%), das über “keinerlei Erfahrung” berichtete. 14% hatten bereits “erste klinische Studien” gestartet und 9% sogar schon “viele klinische Studien” durchgeführt. Damit hatte ein Großteil der Gäste in unserem Event weniger Erfahrung im Umgang mit PMCF-Studien und konnte stark vom nachfolgenden Impulsvortrag profitieren.
Impulsvortrag: “PMCF-Studien im Kontext der klinischen Nachbeobachtung erfolgreich meistern”
Um alle Teilnehmer abzuholen, betonte Dr. Andrea Röthler gleich zu Beginn die große Bedeutung von PMCF-Studien. Denn mit ihnen können Hersteller fortlaufend zeigen, dass bei der Anwendung eines Medizinprodukts der Nutzen das Risiko übertrifft und, dass wichtige Sicherheits- und Qualitätsanforderungen eingehalten werden. Da Hersteller häufig durch die EU-MDR zur Durchführung von PMCF-Studien gezwungen sind, war der nachfolgende Punkt, dass PMCF-Studien auch als Chance zur Innovation und zum Erlangen eines Wettbewerbsvorteils genutzt werden können, sicherlich für viele Teilnehmer interessant. So können im Rahmen von PMCF-Studien auch Verbesserungsmöglichkeiten von Produkten erkannt, die Anwenderzufriedenheit erfragt und eventuelle Abweichungen von der ursprünglich geplanten Nutzung identifiziert werden. Im weiteren Verlauf des Vortrags ging Dr. Andrea Röthler auf die Ziele von PMCF, die geeignete PMCF-Strategie, Arten von PMCF-Studien und die Frage, wann PMCF-Studien erforderlich sind, ein.
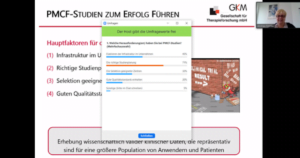
Die zweite Hälfte ihres Vortrages drehte sich um die Frage ‘Was ist wichtig, um PMCF-Studien zum Erfolg zu führen?’. Hier durften sich die Teilnehmer wieder mit einbringen und in einer Live-Umfrage abstimmen, welche der Erfolgsfaktoren für PMCF-Studien in ihrer Praxiserfahrung die größte Herausforderung darstellen. Selbstverständlich war hier eine Mehrfachauswahl möglich, da sich Medizinproduktehersteller bei der Umsetzung von PMCF-Studien häufig mehreren Hürden gegenübergestellt sehen. Der klare Gewinner waren mit 71% die “Herausforderungen bei der richtigen Studienplanung”, gefolgt von “Schwierigkeiten, die richtige Infrastruktur im Unternehmen zu etablieren” (43%). An dritter und vierter Stelle fanden sich jeweils “Herausforderungen bei der Selektion geeigneter Zentren” (32%) und beim “Erreichen eines guten Qualitätsstandards” (20%) ein.
Anschließend gab Dr. Andrea Röthler wertvolle Tipps aus ihrer Praxiserfahrung, wie mit diesen Schwierigkeiten umgegangen werden kann.
- Infrastruktur im Unternehmen: Um einen reibungslosen Ablauf der Studien gewährleisten zu können, müssen Hersteller sich von Anfang an bewusst sein, dass klinische Studien zusätzliche Anforderungen an Kapazitäten und Know-How mit sich bringen und diese sich nicht einfach zusätzlich in den regulären Ablauf in einer Klinik integrieren lassen. Eine realistische, langfristige Planung muss erfolgen sowie ein Abschätzen des Know-Hows im Unternehmen. Vor allem wenn noch nie eine Studie durchgeführt wurde, sollten Fachexperten mit ins Boot geholt werden.
- Richtige Studienplanung: Eine große Falle, die Dr. Andrea Röthler aus ihrer Praxiserfahrung beschreibt, ist, dass teilweise nicht zielführende Informationen erfragt werden und das eigentliche Ziel der Studie aus den Augen verloren wird. Das Studienziel sollte ganz klar gefasst werden, messbar sein, und das anschließende Studiendesign muss genau auf dieses Studienziel angepasst werden.
- Selektion geeigneter Zentren: Die Rekrutierung von Teilnehmern stellt die Forschung immer vor eine große Herausforderung und bei PMCF-Studien sieht dies nicht anders aus. Im Vortrag wurde der Tipp gegeben, Medizinprodukteberater miteinzubeziehen, um für die Bedeutsamkeit von PMCF-Aktivitäten in Kliniken zu werben, sowie sich bei Studien auch an medizinisches Personal zu wenden, das sich eventuell noch in der Facharztausbildung befindet und an der Mitwirkung bei Studien und Publikationen interessiert ist.
- Guter Qualitätsstandard: Wichtig für eine qualitativ hochwertige Studie ist das Beachten der Prinzipien der “Guten Klinischen Praxis” (also das Einhalten des Studienprotokolls, ethischer Grundsätze, ein adäquates Monitoring, usw.). Natürlich hat es uns gefreut, dass Dr. Andrea Röthler auch ihre positiven Erfahrungen mit elektronischer Datenerhebung geteilt hat und diese empfohlen hat, um die hohen Standards, die an klinische Studien gestellt werden, zu erfüllen.
In der letzten Viertelstunde kamen zahlreiche Fragen und Impulse aus dem Publikum, die unsere Referentin ausführlich beantwortete. Und wieder einmal haben wir gemerkt: Die Zeit reichte einfach nicht aus, um dieses spannende Thema abschließend zu diskutieren! Wie gut, dass das nächste MedTech Connect-Event schon feststeht: “IVDR als Chance” am 24. Juni 2021.
Abschließend möchten wir uns ganz herzlich bei Dr. Andrea Röthler für ihre Zeit und Expertise bedanken sowie bei allen Teilnehmern für ihr Interesse und ihren tollen Input!
Vortragsfolien von MedTech Connect
Wer bei MedTech Connect nicht dabei sein konnte, aber dennoch keine spannenden Informationen zu PMCF-Studien verpassen will, kann hier die Webinar-Folien zum Download anfordern.
Speaker gesucht!
Haben Sie auch Lust, mal als Referent an MedTech Connect teilzunehmen? Wir freuen uns, von Ihnen zu hören! Schreiben Sie uns eine kurze Nachricht an hello@climedo.de!
Über GKM Gesellschaft für Therapieforschung mbH
GKM (Gesellschaft für Therapieforschung mbH) ist ein unabhängiges Auftragsforschungsinstitut (CRO), das sowohl für die pharmazeutische Industrie als auch für Hersteller von Medizinprodukten ein umfassendes Leistungsspektrum anbietet.
Ihre Hauptkompetenz liegt in der Planung und dem Management von nationalen und internationalen klinischen Studien auf der Basis der ICH-GCP-Richtlinien sowie in der Durchführung von nicht-interventionellen Studien.
Seit der Gründung im Jahr 1981 hat das Unternehmen über 600 Projekte mit ca. 1,4 Millionen Patienten durchgeführt. Das 85-köpfiges Team aus internen Mitarbeitern und 90 freiberuflichen Clinical Study Monitors (CRAs) steht seinen Kunden mit fundiertem wissenschaftlichen, organisatorischen und administrativen Know-how zur Seite. Mehr erfahren: www.gkm-therapieforschung.de