Klinische Studien: Was läuft gut und was könnte verbessert werden?

DATUM
26. August 2021
AUTOR
Sascha | Co-Founder & CEO
Gemeinsam mit Curedatis haben wir im vergangenen Monat Unternehmen aus der MedTech- und Pharma-Branche nach ihren Erfahrungen in klinischen Studien gefragt. 60 Unternehmen aus Europa, darunter zahlreiche Medizinproduktehersteller, haben uns mitgeteilt, worin die Herausforderungen und Chancen in der Planungs-, Durchführungs- und Abschlussphase liegen und wie sie das Digitalisierungspotenzial in den einzelnen Phasen klinischer Studien einschätzen. Aufgrund der Unterschiede zwischen klinischen Studien vor und nach Marktzulassung eines Produkts, wurde hier auch nochmal gezielt für die jeweilige Phase nachgefragt.
Umfrageergebnisse: Herausforderungen und Chancen in klinischen Studien
- Dauer, Herausforderungen und Chancen der einzelnen Phasen
- Digitalisierungspotenzial und Digitalisierungstrends in den einzelnen Phasen
- Blick in die Zukunft klinischer Studien
- Erfahrung mit dezentralen Studien

Welche Phase ist die schwierigste?
Wer Erfahrungen mit klinischen Studie hat, weiß, dass jede Studienphase ihre eigenen Herausforderungen mit sich bringt. Eine Studie beansprucht nämlich schon vor dem “First Patient In” viel Aufwand für die Planung und ist auch nicht mit dem letzten Studienteilnehmer (“Last Patient Out”) abgeschlossen. Denn selbst in der Abschlussphase erwarten Unternehmen weitere wichtige Aufgaben wie die Datenanalyse und das Publizieren der Ergebnisse.
In unserer Umfrage hat sich die Durchführungsphase als die schwierigste Phase herausgestellt (diese erreichte auf einer Skala von 1 bis 5, wobei höhere Werte eine höhere wahrgenommene Schwierigkeit implizieren, einen Durchschnittswert von 3,4). Auf sie folgten die Planungsphase (3,2 von 5) und die Abschlussphase (2,8 von 5).
Was sind die größten Schwierigkeiten in der Planungsphase?
In der Planungsphase wird das Studiendesign und -protokoll definiert. Außerdem muss ein positives Ethikvotum vor dem Studienstart vorliegen und dafür muss das gesamte Studienvorgehen in einem Ethikantrag ausgeführt werden. Zusätzlich fallen eventuell Durchführbarkeitsanalysen, Benutzerakzeptanztests in die Studienanlaufphase.
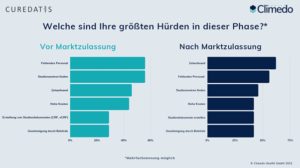
Unsere Umfrageteilnehmer berichteten, dass eine der größten Schwierigkeiten der große Zeitaufwand (46% vor Marktzulassung und sogar 62% nach Marktzulassung) sei, dem sie sich in der Planungsphase gegenüberstehen sehen. Vermutlich eng verbunden damit wurde auch fehlendes Personal (56% je vor und nach Marktzulassung) als weiterer Faktor genannt, was die Planungsphase erschwert (Abb. 1).
Abbildung 1. Hürden in der Planungsphase.
Was sind die Hürden in der Durchführungsphase?
Die Planungsphase ist geschafft, was kommt als nächstes? In der Durchführungsphase stehen die Patientenrekrutierung sowie die Erfassung hochqualitativer Daten von Studienteilnehmer auf der Agenda. Außerdem fallen teilweise Patientenaufnahmen und -Screenings, Visiten, sowie die Patientenüberwachung und -entlassung an – je nachdem in welchem Setting die klinische Studie durchgeführt wird.
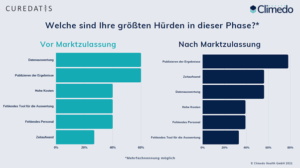
In dieser Phase wurde von den Befragten die Komplexität des Studienprotokolls (69% vor und 50% nach Marktzulassung) als maßgebliche Hürde genannt sowie Schwierigkeiten bei der Identifizierung geeigneter Probanden (56% je vor und nach Marktzulassung) angegeben. Doch, wie klappt denn eigentlich eine effektive Rekrutierung von geeigneten Patienten? Und, wenn ich meine Produktanwender identifiziert habe, wie kann ich sie dann auch zur Studienteilnahme motivieren?
5 Tipps zur Motivation von Produktanwendern, Feedback abzugeben
- Laut unserer MDR-Umfrage haben 27 % der Hersteller Probleme damit, ihre Produktnutzer zu motivieren, Feedback zu geben
- Viele haben auch keine Berührungspunkte mit ihren Anwendern oder wissen nicht, wer diese sind
- Dieses Whitepaper bietet Ihnen fünf praktische Tipps, um eine bessere Einbindung Ihrer Produktnutzer zu erreichen

Welche Schwierigkeiten birgt die Abschlussphase?
In der Abschlussphase müssen dann die erfassten Studiendaten nochmal auf Qualität und Vollständigkeit überprüft werden – idealerweise haben Sie für die Studiendurchführung eine EDC-Software (Electronic Data Capture; Software für die elektronische Erfassung von Studiendaten) genutzt, dann entfällt dieser Schritt fast vollkommen. Schließlich wird eine statistische Analyse der Daten durchgeführt, ein Abschlussbericht der Ergebnisse erstellt und diese veröffentlicht. Und genau in den letztgenannten Punkten liegen unseren Umfrageteilnehmern zufolge die größten Herausforderungen. 60% der Teilnehmer nannten die Datenauswertung in Studien vor Marktzulassung als Schwierigkeit und 56% in Studien nach der Marktzulassung. Der Publikationsprozess birgt auch die ein oder andere Schwierigkeit, daher ist es nicht verwunderlich, dass in Studien vor der Marktzulassung 60% diesen Studienschritt als schwierig einstufen – in Studien nach der Marktzulassung sind es sogar 79% (Abb. 2).
Abbildung 2. Hürden in der Abschlussphase.
Wie steht’s um die Digitalisierung in klinischen Studien?
Dass die Digitalisierung in klinischen Studien teilweise noch zu Wünschen übrig lässt, ist bekannt. Doch gibt es möglicherweise Bereiche, in denen die Studienteilnehmer den größten Bedarf an digitalen Lösungen sehen und sich einen vermehrten Einsatz von diesen wünschen?
In der Planungsphase wurde hier die Machbarkeitsanalyse genannt (3,5 von 5), gefolgt von der Kommunikation mit Behörden (3,2 von 5) und der Patientenrekrutierung (3,1 von 5). In der Durchführungsphase waren es wiederum die Datenerhebung (3,9 von 5), die Kommunikation mit Patienten (3,8 von 5) und das Monitoring (3,7 von 5), welche laut der Befragten noch digitalisiert werden könnten. In der Abschlussphase nannten sie vor allem das Datenmanagement (4,2 von 5), den Datenexport und die statistische Analyse (je 4,0 von 5).
Blick in die Zukunft
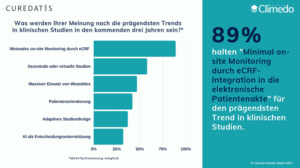
Wie werden sich klinische Studien in den kommenden Jahren verändern? Welche Trends werden die Landschaft klinischer Datenerhebung prägen? Für die kommenden drei Jahre wurden “Minimales on-site Monitoring durch eCRF-Integration in die elektronische Patientenakte” (89%), “dezentrale oder virtuelle Studien” (58%) und der “massive Einsatz von Wearables” (47%) als wichtigste Trends genannt (Abb. 3).
Abbilung 3. Einschätzung zukünftiger Trends in klinischen Studien.
Außerdem planten mehr als zwei Drittel der Teilnehmer in den kommenden drei Jahren dezentrale Studien durchzuführen. Als Vorteile von dezentralen Studien wurden Kosteneinsparungen (75%), schnellere Studienabschlüsse (70%) und vereinfachte Patientenrekrutierung (50%) von den Teilnehmern genannt, die bereits Erfahrungen mit dezentralen Studien hatten.
Allgemein wünschten sich die Befragten “mehr Bereitschaft für den Einsatz digitaler Technologien” (74%), eine “bessere Kommunikation mit durchführenden Zentren” (68%) sowie “klare Kommunikation der Anforderungen vom Staat (etwa in Bezug auf Gesetze und Verordnungen)” (58%), um das klinische Studienverfahren für Unternehmen zu erleichtern.
Sie möchten mehr erfahren? Die vollständigen Umfrageergebnisse können hier kostenfrei heruntergeladen werden.
Über Curedatis
Curedatis ist ein Start-up, das den Prozess der klinischen Evidenz digitalisiert und automatisiert, um Medizinprodukte-, In-vitro-Diagnostik- und Digital-Health-Unternehmen dabei zu unterstützen, die Anforderungen an eine ausreichende klinische Evidenz gemäß der MDR, IVDR und DiGAV zu erfüllen.