Wie PMCF Medizintechnik-Unternehmen einen Mehrwert bringen kann

DATUM
04. Mai 2020
AUTOR
Benjamin Sauer | VP Engineering
Post-Market Clinical Follow-up (PMCF) bzw. klinische Nachbeobachtung nach dem Inverkehrbringen ist eine relativ neue Anforderung im europäischen MedTech-Sektor. Bis vor kurzem war sie nur für höhere Risikoklassen erforderlich (basierend auf MEDDEV 2.12-2), aber nach der Europäischen Medizinprodukteverordnung (EU-MDR) ist sie für alle Produkt-Risikoklassen verpflichtend. PMCF ist ein kontinuierlicher Prozess, welcher Restrisiken im Zusammenhang mit auf dem Markt befindlichen Medizinprodukten identifiziert und untersucht und die klinische Bewertung in einem Lebenszyklusansatz aktualisiert.
Vor Inkrafttreten der EU-MDR lag die PMCF-Verantwortung typischerweise beim Qualitätsmanagement und/oder Regulatory Affairs und wurde oft nur von Medizinprodukteherstellern der höchsten Risikoklassen durchgeführt. Doch nach der neuen Verordnung muss die PMCF-Datenerhebung ein proaktiver Prozess sein, der von mehreren Abteilungen durchgeführt wird. So können z.B. Vertriebs- und Marketingabteilungen Daten zur Verbesserung ihres Produkt-Messaging sammeln und nutzen (etwa durch Literatur, Online-Foren oder soziale Medien), und das Anwender-Feedback kann zu neuen Erkenntnissen in der Geschäftsentwicklung führen.
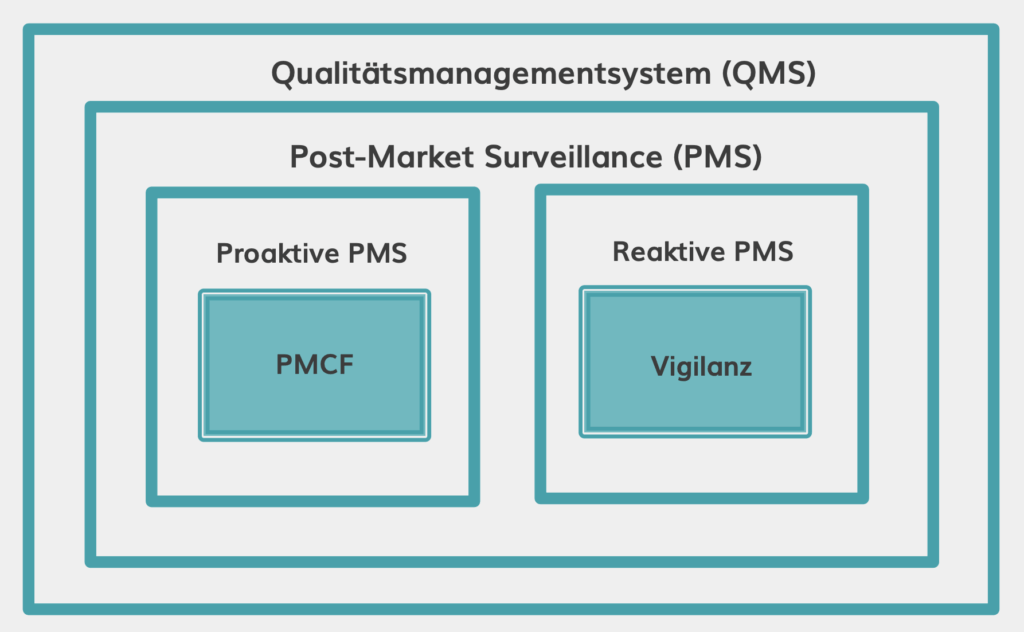
PMS und PMCF als Teil des Qualitätsmanagementsystems
Zwar werden die neuen PMCF-Anforderungen nach EU-MDR-Gesetz vermutlich zunächst für erhöhte Kosten sorgen, doch können Unternehmen dieses Potenzial langfristig als Kapitalrendite (ROI) nutzen. Im Folgenden haben wir vier Bereiche zusammengestellt, in denen PMCF für MedTech-Unternehmen einen Mehrwert liefern kann.
Vorteil 1: Kontinuierliches Feedback von Endnutzern aus der Praxis
Die Nutzung klinischer Daten aus einer Vielzahl von Quellen ist für einen robusten PMCF-Prozess unerlässlich. Für Medizinprodukte niedrigerer Risikolassen ist möglicherweise keine komplette PMCF-Studie erforderlich. Doch können Informationen aus verschiedenen Quellen genutzt werden, um das Risiko-Nutzen-Verhältnis (Risk-Benefit Ratio) eines Medizinprodukts angemessen darzustellen. Ein sorgfältig formulierter PMCF-Prozess kann Hersteller mit Anwendern wie Ärzten oder Patienten (solange anonymisiert) verknüpfen, die das Gerät nutzen. Produkt-Anwender können so ermutigt werden, Herstellern direktes Feedback zur Leistung oder Sicherheit eines Produkts zu geben. Im Zeitalter der Digitalisierung können viele dieser Daten auch elektronisch erfasst werden, z.B. durch Online-Umfragelinks, die per E-Mail oder SMS verschickt werden. Endnutzer-Feedback wird dann mithilfe von ePRO- oder eCOA-Lösungen gesammelt und in ein web-basiertes System übertragen, auf das alle relevanten Stakeholder Zugriff haben. Dies ermöglicht eine kontinuierliche Verbesserung der Geräte und letztlich einen stärkeren Wettbewerbsvorteil auf dem Markt.
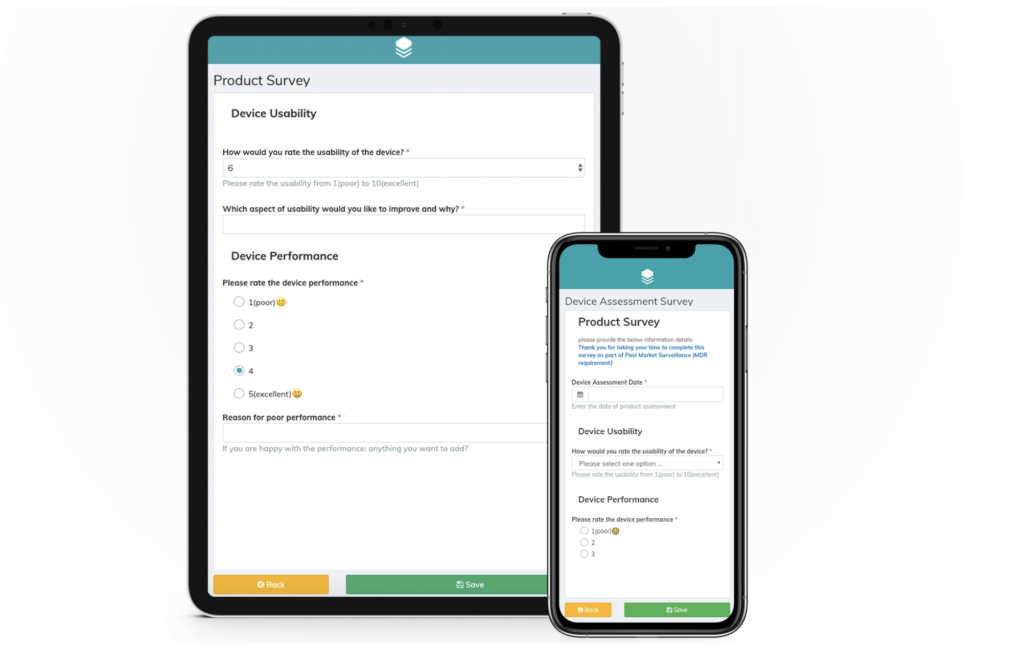
Beispiel einer PMCF-Anwender-Umfrage für ein Medizinprodukt
Vorteil 2: Neue Geräte-Indikationen mithilfe von PMCF
Sobald eine Feedback-Schleife zwischen Herstellern und Anwendern hergestellt wurde, kann diese dazu dienen, das Verhalten des Medizinprodukts in verschiedenen Umgebungen zu testen und aufzuzeichnen. Ein großer Vorteil ist, dass eine mögliche nicht-konforme Off-Label-Verwendung gekennzeichnet und der zuständigen Behörde gemeldet werden kann. Häufig kann dies auch als Katalysator dienen, um potenzielle neue Indikationen für das Gerät zu entdecken und gleichzeitig die behördlichen Anforderungen zu erfüllen. Der Hersteller kann diese Einsatzmöglichkeiten auch bei der nächsten Konstruktionsänderung testen und sie als gültige, geprüfte und konforme Indikation in die Gebrauchsanweisung integrieren.
Vorteil 3 : Verbesserte Produktvermittlung über verschiedene Abteilungen hinweg
Selbst Medizinprodukte, die eine umfassende klinische Studie zur Erlangung der CE-Kennzeichnung durchlaufen haben, können manchmal von skeptischen Anwendern nicht gut aufgenommen werden. Das Sammeln von Daten nach der Markteinführung kann einen Mehrwert bringen, indem es einen plausiblen Business Case unterstützt. Gängige Beispiele sind der Vergleich der Geräteleistung mit der eines Wettbewerbers oder die Präsentation evidenzbasierter Ergebnisse auf Fachmessen. Darüber hinaus können Daten oftmals zur Erstellung eines fairen Preismodells genutzt werden, um den Geräteumsatz zu verbessern. Vertriebs- und Marketingabteilungen können von den kommerziellen Aspekten von PMCF profitieren, indem sie sich auf Feedback zur Nutzerfreundlichkeit, Daten zur Lebensqualität und Patientenstimmen stützen, um die Produkt- und Marketing-Claims anzupassen. Dies dürfte auch die Akzeptanz des Geräts auf dem Markt verbessern.
Vorteil 4: Nutzen Sie PMCF zum Aufbau eines Netzwerks vertrauenswürdiger Berater
Fachkräfte in Kliniken verwenden jeden Tag eine breite Vielfalt an Medizinprodukten. Mit der EU-MDR wird erwartet, dass dieses Personal darüber hinaus eine überwältigende Anzahl von Anfragen zur Bereitstellung klinischer Daten für PMCF erhalten wird. Da das Personal bereits jetzt mit zu wenig Zeit und knappen Ressourcen überlastet ist, wäre es keine nachhaltige Strategie, sich bei der Erhebung von PMCF-Daten auf „unangemeldete Anrufe“ zu verlassen. Die Erfassung klinischer Daten für PMCF muss während des gesamten Produktlebenszyklus erfolgen. Aus diesem Grund können Hersteller die Vorschriften der EU-MDR zu ihrem Zweck nutzen. Die Datenerfassung für PMCF kann als Grundlage für den Aufbau eines Netzwerks von Key Opinion Leaders (KOLs) und klinischen Experten verwendet werden, die mit ihrem Gerät arbeiten und Anreize erhalten, klinische Daten zur Geräteleistung zu liefern. Da PMCF-Aktivitäten robuste klinische Daten erfordern, bringt ein medizinischer Beirat aus KOLs und klinischen Experten einen Mehrwert, indem er praktische Erfahrungen mit dem Gerät in der Post-Market-Umgebung liefert.
Die EU-MDR läutet eine neue Ära von Regelungen ein, die eine Umstrukturierung der bestehenden Einhaltungsmechanismen erfordern. PMCF wird jetzt als Anforderung für alle Produktklassen angesehen und wird für die Aufrechterhaltung der CE-Kennzeichnung und für das Bestehen unangekündigter Audits durch Benannte Stellen unerlässlich sein. Auch wenn die Kosten kurzfristig steigen könnten, sollten MedTech-Unternehmen PMCF nicht als zusätzliche Belastung betrachten, sondern als Investition in eine eingehende Marktanalyse. PMCF-Aktivitäten können einen Mehrwert bringen, indem sie eine Feedback-Schleife zwischen Herstellern und Endnutzern bilden, die viele neue Vorteile bietet. Eine gut formulierte PMCF-Strategie zeigt Behörden, dass die Qualität proaktiv und nicht nur als Nachtrag bewertet wird. PMCF-Daten können evidenzbasierte Ergebnisse unterstützen und neue Einsichten in die reale Anwendung von Geräten liefern, welche wiederum für verbesserte Marketing-Aktivitäten und Geschäftsentwicklung genutzt werden können. Robuste PMCF-Aktivitäten können durch die Aktualisierung klinischer Bewertungen und die Dokumentation von Restrisiken über alle organisatorischen Prozesse hinweg Wert schaffen. Auf diese Weise kann PMCF dazu beitragen, regulatorische Pfade zu lenken, Möglichkeiten zur Kommerzialisierung auszuschöpfen und mehr Innovation zu ermöglichen.
Die effiziente Erfassung klinischer Daten bildet den Kern einer robusten und effektiven klinischen Nachbeobachtung. Hersteller müssen somit in der Lage sein, klinische Daten unter Einhaltung aller erforderlichen Standards und Vorschriften einfach zu erfassen und zu speichern. Climedo kann Ihre Datenerfassungsprozesse für PMCF durch eine sichere, ganzheitliche und vernetzte Plattform beschleunigen. So werden Daten für interne Zwecke zugänglich und können für den Austausch und die Geschäftsentwicklung genutzt werden, indem sie in die Dokumentation einfließen, die beispielsweise für Audits benötigt wird.
Möchten Sie mehr erfahren? Sichern Sie sich jetzt Ihren persönlichen Test-Zugang – natürlich kostenfrei und unverbindlich.





