Medizinprodukte Einmaleins // Zahnimplantate
DATUM
12. Oktober 2020
AUTOR
Benjamin Sauer | VP Engineering
Was sind Zahnimplantate?
Zahnverlust ist ein weltweit immer häufiger auftretendes Problem, das durch Mundkrankheiten, mangelnde Mundhygiene, schlechte Ernährung oder Unfälle verursacht werden kann. Zahnimplantate, d.h. Ersatz-Zahnwurzeln, werden zur Unterstützung von Zahnersatz oder Zahnprothesen im Mund des Patienten angebracht. Diese Medizinprodukte bieten eine solide Grundlage für permanenten oder herausnehmbaren Zahnersatz und werden so hergestellt, dass sie den natürlichen Zähnen des Patienten entsprechen.
Der weltweite Markt für Zahnimplantate wurde im Jahr 2019 auf 4,6 Milliarden US-Dollar geschätzt und soll in den nächsten sieben Jahren mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 9% wachsen (Quelle: Grand View Research). Angesichts ihrer zahlreichen Vorteile, wie etwa Haltbarkeit, Sicherheit, Wirksamkeit und natürlich aussehende Zähne, wird die Nachfrage nach Zahnimplantaten wahrscheinlich auch in Zukunft weiter steigen. Der Markt wird weiter angetrieben durch ein wachsendes Bewusstsein für Mundhygiene, das globale Wirtschaftswachstum (Stand 2019) und den Pro-Kopf-Ausgaben für die Gesundheitsfürsorge sowie eine zunehmende Bedeutung der ästhetischen Wiederherstellung von Zahnimplantaten.
Mit der COVID-19-Pandemie hat die Dentalindustrie – wie zahlreiche andere Sektoren auch – jedoch einen großen Rückschlag erlitten. Die Auswirkungen werden noch jahrelang zu spüren sein. Im Großen und Ganzen ist mit einem Rückgang der zahnärztlichen Leistungen zu rechnen, da sich elektive Eingriffe verzögern und andere, dringendere Fälle priorisiert werden.
Als Geräte der relativ hohen Risikoklasse werden Zahnimplantate in der Regel als IIb klassifiziert. Im Folgenden werden wir verschiedene Aspekte von Zahnimplantaten analysieren und darauf eingehen, was Hersteller mit der neuen Medizinprodukteverordnung (EU-MDR) bei ihrer klinischen Datenerhebung beachten müssen.
Wie werden Zahnimplantate eingesetzt?
Bei einer Zahnimplantatoperation macht der Kieferchirurg einen Schnitt, um das Zahnfleisch des Patienten zu öffnen und den Knochen freizulegen. Nach Anlegen der Bohrschablone an den Kiefer wird das Implantatbett für die Implantate in den Kiefer gebohrt. Man unterscheidet zwei- und einteilige Implantatsysteme: Bei zweiteiligen Implantaten wird das Zahnfleisch über dem Implantatkopf vernäht, sodass dieses geschlossen einheilen kann. Bei einteiligen Implantaten dagegen erfolgt offenes Einheilen. Dann wird zunächst ein partieller, provisorischer Zahnersatz eingesetzt . Durchgesetzt haben sich heutzutage überwiegend Schraubenimplantate.
Diese Implantate haben einen runden Querschnitt, welche in den Knochen gedreht werden. Nach der Operation wird der Patient einige typischen Beschwerden verspüren, die bei den meisten zahnärztlichen Eingriffen auftreten. Sehr wichtig sind jetzt eine gute Mundhygiene und desinfizierende Spülungen, um eine Infektion der Wunde über dem Implantat zu vermeiden. Einige Patienten bekommen vom Zahnarzt ein Antibiotikum, um einer Entzündung vorzubeugen.
Welche Arten von Zahnimplantaten gibt es?
In der modernen Zahnmedizin haben Ärzte und Patienten eine Auswahl von über 100 verschiedenen Implantatlösungen. Diese Systeme unterscheiden sich sowohl in ihrer Form als auch ihrem Material. Für Patienten sind vor allem Kriterien wie Haltbarkeit, Entzündungsrisiko und Kosten am wichtigsten. Die meisten Produkte stammen von Implantatherstellern aus Deutschland, Frankreich, Israel, Korea, der Schweiz, Schweden und den USA. Unterschieden werden sie vor allem in ihrer Form, dem verwendeten Material, ihrer Oberfläche sowie ihrer Größe. Diese Eigenschaften wirken sich wiederum auf die Kosten aus.
Ein Hauptunterschied besteht darin, ob das Implantat aus einem oder zwei Teilen besteht. Einteilige Implantate bieten im Vergleich zu zweiteiligen Implantaten Vorteile wie niedrigere Kosten in der Produktion sowie eine höhere Bruchfestigkeit. Das zweiteilige Implantatsystem besteht aus einem Implantatkörper – der direkt in den Kieferknochen eingesetzt wird – als auch aus der “Suprakonstruktion ”, dem sichtbaren Zahnersatz. Bei dem einteiligen Implantatsystem ist die Suprakonstruktion bereits in den Implantatkörper eingearbeitet.
Wie sieht das neue Verfahren zur Zertifizierung und Überwachung von Zahnimplantaten im Rahmen der EU-MDR aus?
Obwohl die neue Medizinprodukteverordnung (EU-MDR 2017/745) besagt, dass implantierbare medizinische Geräte und medizinische Geräte der Klasse III als Geräte der höheren Risikoklasse definiert werden und spezifischen Sicherheits- und Leistungsanforderungen unterliegen sollten, sind Zahnimplantate von dieser Regel ausgenommen. Paragraph 3 in Artikel 18 der EU-MDR legt fest:
Die folgenden Implantate sind von den in diesem Artikel festgelegten Verpflichtungen ausgenommen: Nähte, Klammern, Zahnfüllungen, Zahnspangen, Zahnkronen, Schrauben, Keile, Platten, Drähte, Stifte, Klammern und Verbindungselemente. Die Kommission wird ermächtigt, delegierte Rechtsakte gemäß Artikel 115 zu erlassen, um diese Liste durch Hinzufügung anderer Arten von Implantaten zu dieser Liste oder durch Entfernen von Implantaten aus dieser Liste zu ändern.
Als Medizinprodukte der Klasse IIb, die etwa 8% des Marktanteils der Medizinprodukte ausmachen (Quelle: Johner Institut), unterliegen Zahnimplantate mehreren rechtlichen Anforderungen. Als nächstes werden wir beschreiben, welche Änderungen mit der EU-MDR gegenüber der MDD (Medical Device Directive) zu erwarten sind.
Konformitätsbewertung
Laut MDR beschreibt die Konformitätsbewertung ein Verfahren, mit dem geprüft werden soll, ob ein Medizinprodukt die MDR-Anforderungen erfüllt oder nicht. Die Konformitätsbewertung von Medizinprodukten für die CE-Kennzeichnung (Kapitel V Abschnitt 2) variiert je nach Risikoklasse des Produkts und spezifischen Merkmalen bestimmter Produkte (Artikel 52). Für Zahnimplantate als Klasse-IIb-Produkte müssen Implantathersteller entweder ein vollständiges Qualitätsmanagementsystem (QMS) nach ISO 13485 oder Anhang IX vorweisen sie müssen Anhang XI befolgen.
Zudem ist eine Musterprüfung für Zahnimplantate gemäß Anhang X erforderlich (wenn Anhang IX nicht befolgt wird). Diese Musterprüfung bedeutet, dass der Implantathersteller auch wirklich ein Medizinprodukt entwickelt. Vor der Herstellung und dem Verkauf des Zahnimplantats überprüft die Benannte Stelle des Herstellers die Konformität des Implantats mit den “Allgemeinen Sicherheits- und Leistungsanforderungen”. Eine Herausforderung dabei ist, dass es derzeit einen Mangel an MDR-zertifizierten Benannten Stellen in der EU gibt und dass viele wichtige Benannte Stellen erst vor kurzem als MDR-konform zugelassen wurden und sich nun mit dem Massenzustrom von MDR-Anwendungen befassen. Die Hersteller sollten daher in dieser Hinsicht Verzögerungen einplanen.
Post-Market-Überwachung
Während sich die MDD stark auf die Phase vor dem Inverkehrbringen von Medizinprodukten konzentrierte, besteht das Ziel der EU-MDR darin, die Leistung und Sicherheit der Geräte während ihres gesamten Lebenszyklus zu gewährleisten, das bedeutet also auch im Markt. Grund hierfür ist, dass bestimmte Risiken erst dann sichtbar werden, wenn ein Gerät bereits von einem Arzt zur Behandlung eines Patienten eingesetzt wird. Daher müssen Hersteller nicht nur die von Zahnimplantaten ausgehenden Risiken minimieren und ihre Sicherheit vor dem Inverkehrbringen (durch Konformitätsbewertung mit einer Benannten Stelle) gewährleisten, sondern ihre Zahnimplantate weiterhin überwachen und Daten über sie sammeln, nachdem sie auf den Markt gebracht wurden.
Hier kommt die Überwachung nach dem Inverkehrbringen (Post-Market Surveillance / PMS) ins Spiel. Ihr Ziel ist es, diese Risiken in der praktischen Anwendung des Produkts systematisch zu identifizieren, die Leistung der Produkte zu überprüfen, Produktfehler und unentdeckte Sicherheitsprobleme aufzudecken, die Nutzen-Risiko-Bewertung kontinuierlich zu aktualisieren und notwendige Maßnahmen wie Produktrückrufe im Falle von unerwünschten Ereignissen rasch einzuleiten. Die Verantwortung von PMS liegt beim Hersteller, jedoch können Hersteller auch die Händler ihrer Produkte dazu verpflichten, ebenfalls Daten für PMS zur Verfügung zu stellen. Beispielsweise ist der Händler in der Regel auch ein Berater für Medizinprodukte, der somit verpflichtet ist, dem Hersteller Informationen über die Sicherheit der Produkte zur Verfügung zu stellen.
PMS- und PMCF-Aktivitäten in der EU-MDR-Ära meistern
Proaktive und reaktive PMS
Es gibt zwei Arten von PMS: proaktiv und reaktiv. Reaktive PMS, auch “Vigilanz” genannt, bedeutet, dass erst nach einem Vorfall reagiert wird, z.B. nach einer Beschwerde oder einer schweren Verletzung oder in extremen Fällen sogar nach dem Tod eines Patienten aufgrund eines Medizinprodukts. Zu den möglichen Risiken bei Zahnimplantaten zählen unter anderem Entzündungen, erhöhter Knochenverlust, Perforation während der Operation, Implantatbruch oder -fraktur sowie Nervenschäden. Da reaktive PMS in der Regel mit der Datenerfassung verbunden ist, wird es als “passive” Aktivität betrachtet.
Bei der proaktiven PMS hingegen soll ein schwerer Vorfall vorhersehbar sein oder verhindert werden, bevor er eintritt. Dies kann in Form von Umfragen unter Endanwendern (in diesem Fall dem Zahnarzt oder Implantologen, der das Implantat einsetzt), Implantatregistern, Fachgruppen oder klinischen Folgestudien nach dem Inverkehrbringen erfolgen. Ziel ist es, wertvolle Daten über die Leistung des Implantats in der Praxis zu gewinnen. Die Analyse und Überprüfung der Daten ist Teil des Risikomanagementprozesses und muss routiniert durchgeführt werden.
| Proaktive PMSR | Reaktive PMS |
|
|
Quelle: Effective post-market surveillance (BSI)
Klinischer Bewertungsbericht
In Vorbereitung auf die EU-MDR müssen Zahnimplantat-Hersteller auch ihre klinische Bewertungsberichte (Clinical Evaluation Reports / CER) für alle Implantate mit einer CE-Kennzeichnung bewerten. Dabei sollten sie gleichwertige Gerätedaten, die in früheren Literaturübersichten verwendet wurden, gegenprüfen, um sicherzustellen, dass sie der strengeren Definition der “Äquivalenz” nach EU-MDR entsprechen. Die CER muss in regelmäßigen Abständen aktualisiert werden, wobei die Häufigkeit für jede Zahnimplantat-Kategorie festgelegt und begründet werden muss, falls es mehr als eine gibt. Dieser Bericht muss aktualisiert werden, wenn neue PMS-Daten die Schlussfolgerung der CER beeinflussen könnten. Im Falle von Zahnimplantaten als Produkt der Risikoklasse IIb sind jährliche Aktualisierungen erforderlich.
Artikel 61, Paragraph 11
Die klinische Bewertung und die dazugehörigen Unterlagen sind während des gesamten Lebenszyklus des Produkts anhand der klinischen Daten zu aktualisieren, die sich aus der Durchführung des Plans für die klinische Nachbeobachtung nach dem Inverkehrbringen des Herstellers gemäß Anhang XIV Teil B und dem Plan zur Überwachung nach dem Inverkehrbringen gemäß Artikel 84 ergeben
Periodic Update Safety Report
Für Zahnimplantate ist ein Periodic Safety Update Report (PSUR) nach Bedarf und mindestens jährlich erforderlich. Dieser Bericht muss auch an die Behörde (auf Anfrage) und die Benannten Stelle herangetragen werden. Eine Übermittlung an die EUDAMED-Datenbank ist hingegen nicht zwingend erforderlich. Ein PSUR sollte dieser Struktur folgen:
- Meta-Informationen einschließlich Referenzen
- Plan-Implementierung
- Produktdaten (einschließlich Umsatz, Indikationen, Patienten)
- Überblick über die Daten (einschließlich unerwünschter Ereignisse)
- Ergebnisse der Analyse (einschließlich Trends)
- Überblick über die ergriffenen Maßnahmen (einschließlich CAPA, Wachsamkeit, FSCA)
- Schlussfolgerungen aus dem Risiko-Nutzen-Verhältnis
- Abschließende Beurteilung
Quelle: Johner Institut.
Post-Market Clinical Follow-up
Nicht zuletzt ist die klinische Nachbeobachtung nach dem Inverkehrbringen (Post-Market Clinical Follow-up / PMCF) Teil der PMS und ein kontinuierlicher und verpflichtender Prozess zur Erfassung klinischer Daten über ein Zahnimplantat in Zusammenhang mit seiner Zweckbestimmung. Ziel von PMCF ist es, die Sicherheit und klinische Leistung des Zahnimplantats fortlaufend zu bestätigen. Die zu einem auf dem Markt befindlichen Implantat gesammelten Daten dienen dem Nachweis, dass die identifizierten Risiken im Zusammenhang mit dem klinischen Nutzen des Implantats akzeptabel bleiben. Es gibt verschiedene Methoden zur Durchführung von PMCF; die Eignung jeder Methode hängt von Faktoren wie der allgemeinen Verfügbarkeit klinischer Daten für das Implantat, seiner Risikoklasse (IIb) und der Situation auf dem Zahnimplantatmarkt ab. PMCF kann aus Daten bestehen, die aus dem Vigilanzsystem, Beschwerden, technischen Informationen und öffentlich zugänglichen Informationen stammen, und bezieht sich nicht nur auf PMCF-Studien. Eine nützliche PMCF-Methode zur Erhebung klinischer Daten über Zahnimplantaten ist die Verwendung von Umfragen, die wir im nächsten Abschnitt zeigen werden.
Datensammlung – Zeit für digitale Lösungen
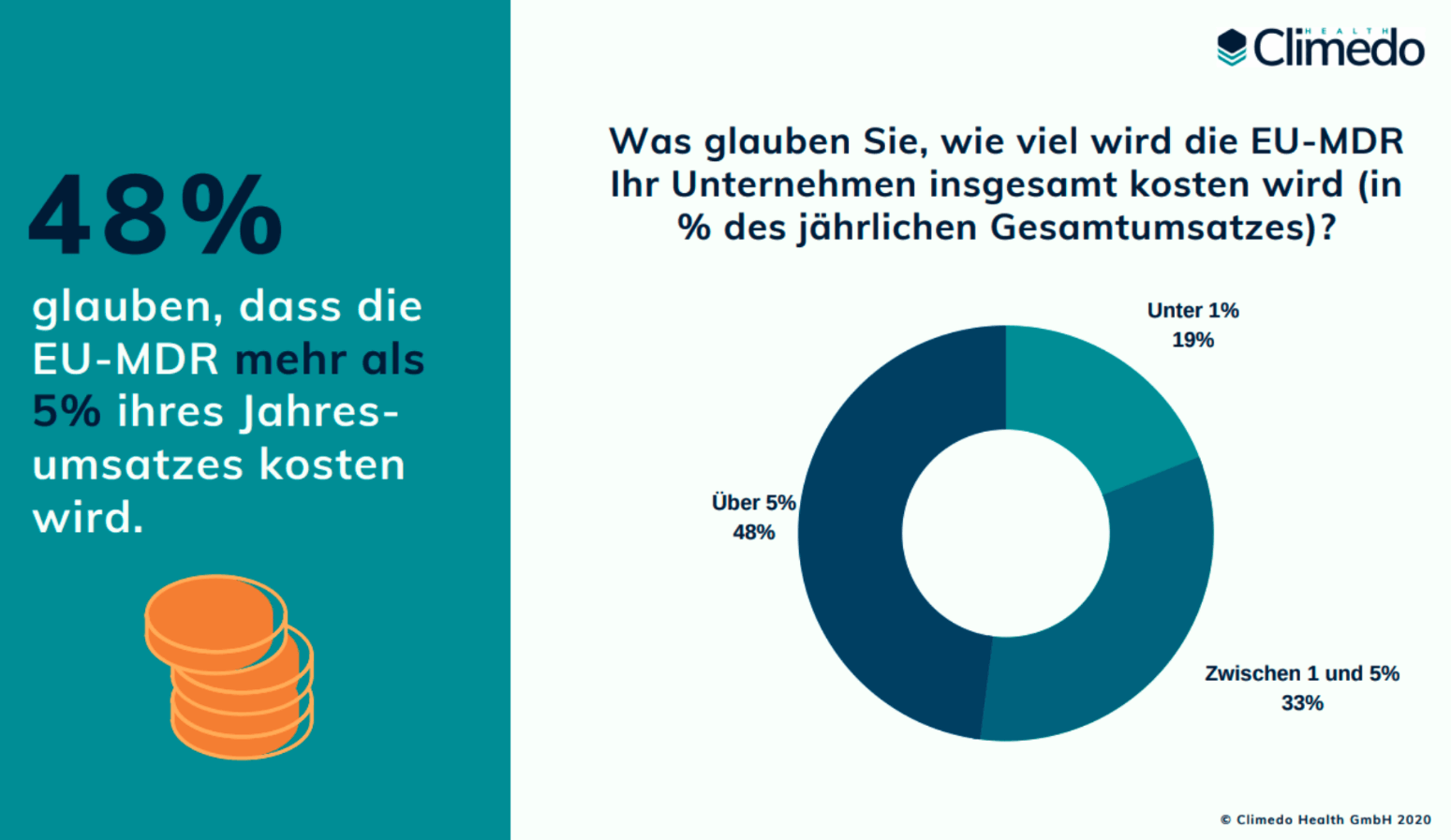
In einer kürzlich durchgeführten Umfrage über die wahren Kosten der EU-MDR stellten wir fest, dass die neue Verordnung erhebliche Ressourcen seitens der Hersteller, insbesondere der Klassen IIb und III, erfordert. Dabei stelle sich unter anderem heraus, dass 55% der Teilnehmer mehr als 5 zusätzliche Stunden pro Woche in die Erfüllung der neuen MDR-Anforderungen investieren. Zwei Drittel stellen mindestens einen neuen Mitarbeiter ein, um die Anforderungen zu bewältigen bzw. haben es vor. Die meiste Zeit fließt für Hersteller in das “Verständnis der neuen Anforderungen” (von 68% genannt), gefolgt von “Klinische Bewertungen und klinische Studien” (63%), während das meiste Geld in die klinische Bewertung sowie klinische Studien (von 75% genannt) fließt, gefolgt von PMS- und PMCF-Aktivitäten (52%). Zudem glauben fast die Hälfte, die neue Verordnung sie mehr als 5% ihres Jahresumsatzes kosten wird.
Außerdem stellten wir einige spezifische Fragen zur klinischen Datenerfassung und dazu, wie die Hersteller aktuell ihre PMCF-Studien handhaben. Dabei stellte sich heraus, dass nur 11% eine EDC-Lösung (electronic data capture) für ihre klinischen Datenerfassung verwenden. 69% nutzen Excel und 47% sogar noch Papier (Mehrfachnennung möglich). 45% verbringen mehr als eine Stunde pro Woche mit der Stakeholder-Kommunikation und und mehr als die Hälfte (51%) haben noch keinen Teil ihrer PMCF-Prozesse automatisiert.
Umfrageergebnisse: Die wahren Kosten der EU-MDR
Die Ergebnisse haben uns gezeigt, dass besonders viel Zeit und Geld in klinische Studien und PMS-Aktivitäten fließen. Und genau hier sollten Hersteller das Potenzial von digitalen, Cloud-basierten Lösungen ausschöpfen. Papierbasierte Systeme, die immer noch von der Hälfte der Teilnehmer verwendet werden, werden aufgrund der strengen regulatorischen Anforderungen an die Datenerfassung in Zukunft nicht mehr mithalten können. Wir glauben, dass eine EDC-Lösung eine der wenigen Möglichkeiten ist, Zeit und Geld zu sparen und sicherzustellen, dass medizinische Geräte nach MDR (re-)zertifiziert werden und nicht vom Markt genommen werden müssen.
Mit EDC-Lösungen können Hersteller Daten über ihre Zahnimplantate in Echtzeit erfassen. Beispielsweise können QR-Codes auf die Geräteverpackung aufgedruckt werden und von Zahnärzte und Implantologen mit einem Smartphone eingescannt werden. Der QR-Code führt sie direkt zur web-basierten Umfrage. Nach Abschluss der Umfrage – die jederzeit und überall durchgeführt werden kann – sind Ergebnisse sofort in der EDC-Software für den Hersteller bzw. die CRO abrufbar. Die Alternative, mit der viele Unternehmen noch immer arbeiten, ist der Papierfragebogen. Dass papierbasierte Lösungen viel mühsamer zu handhaben sind, müssen wir kaum erklären: Sie sind nicht nur weniger sicher (Papierformulare gehen leicht verloren), sie müssen auch hin- und hergeschickt werden, die Handschriften sind oft schwer zu lesen und sie verursachen enorme Verzögerungen, was zu höheren Kosten führt. Wenn sie nicht ausgefüllt werden, muss der Hersteller beim Zahnarzt nachfassen, während er mit einer EDC-Lösung automatische Erinnerungen an die Benutzer des Geräts vorab einplanen kann.
Möchten Sie mehr darüber erfahren, wie auch Ihr Unternehmen mit einer EDC-Lösung Zeit und Geld sparen könnte? Sichern Sie sich jetzt Ihren kostenlosen Climedo-Testzugang:
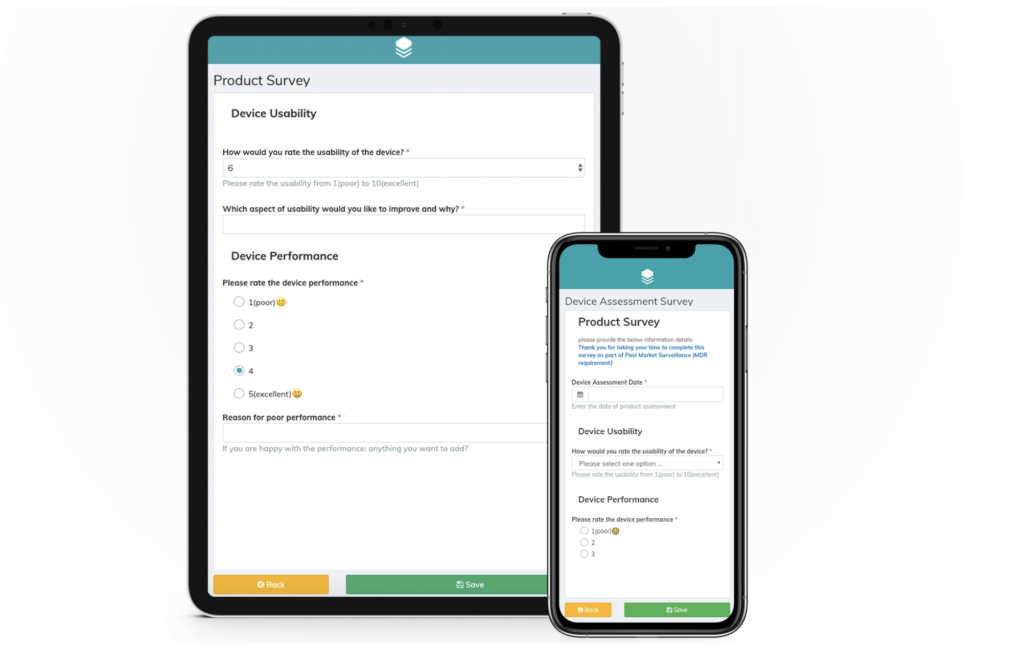
Umfragebeispiel für Zahnimplantate
Wenn Sie eine Live-Umfrage für Zahnimplantate sehen möchten, können Sie sich hier eine PMCF-Umfrage ansehen, die mit der Climedo-Software erstellt wurde.
Alternativ können Sie diesen QR-Code mit Ihrem Smartphone einscannen:
Case Study: BEGO Implant Systems
Anfang 2020 führten wir einen zweitägigen Workshop mit BEGO Implant Systems und führenden nationalen Zahnärzten und Implantologen durch, um einen Plan für eine Clinical Study für BEGO Implant Systems auszuarbeiten. Unser Ziel war es, eine Strategie für eine strukturierte und EU-MDR-konforme Datenerfassung als Teil der PMS- und PMCF-Aktivitäten zu entwickeln und Wege zu finden, den Feedback-Prozess für Endanwender schneller und bequemer zu gestalten.
Alle am Workshop beteiligten Zahnärzte und Implantologen sprachen sich dafür aus, an der geplanten klinischen Umfrage mit Climedo teilzunehmen. Dr. Nina Wilkens, Managerin für klinische Angelegenheiten, BEGO Implant Systems, sagte: “Die teilnehmenden Ärzte waren vom Climedo-System überzeugt, und wir freuen uns darauf, es für unsere PMS-Aktivitäten einzusetzen. Was uns besonders gefällt, sind die einfache Handhabung und die flexiblen Möglichkeiten zur Konfiguration der klinischen Studien. Änderungen an den Eingabemasken können wir in kürzester Zeit selbst vornehmen, ohne die notwendige Unterstützung durch die IT.”