Global denken, lokal handeln: So gelingt ganzheitliche Real-World Evidence

DATUM
16. April 2024
AUTOR
Kristina Weber | Product Lead
Im Mai 2023 haben wir mit Paul Petraro ein 60-minütiges Webinar über ganzheitliche Real-World Evidence (RWE) veranstaltet. Paul Petraro arbeitet als Executive Director und Global Heads im Bereich RWE im Analytic Evidence Center von Boehringer Ingelheim. Dort ist er für das Management und die Überwachung von Real-World-Studien sowie die Entwicklung von RWE-Strategien zuständig.
Als ausgebildeter Epidemiologe mit einem fundierten Hintergrund in epidemiologischen Methoden und Evidenz verfügt er über umfangreiche Erfahrung in Beobachtungs- und experimentellen Studien, Schnellzulassungen und Risikomanagement. Zudem besitzt Paul ein tiefgreifendes Wissen über öffentliche und private epidemiologische Ressourcen.

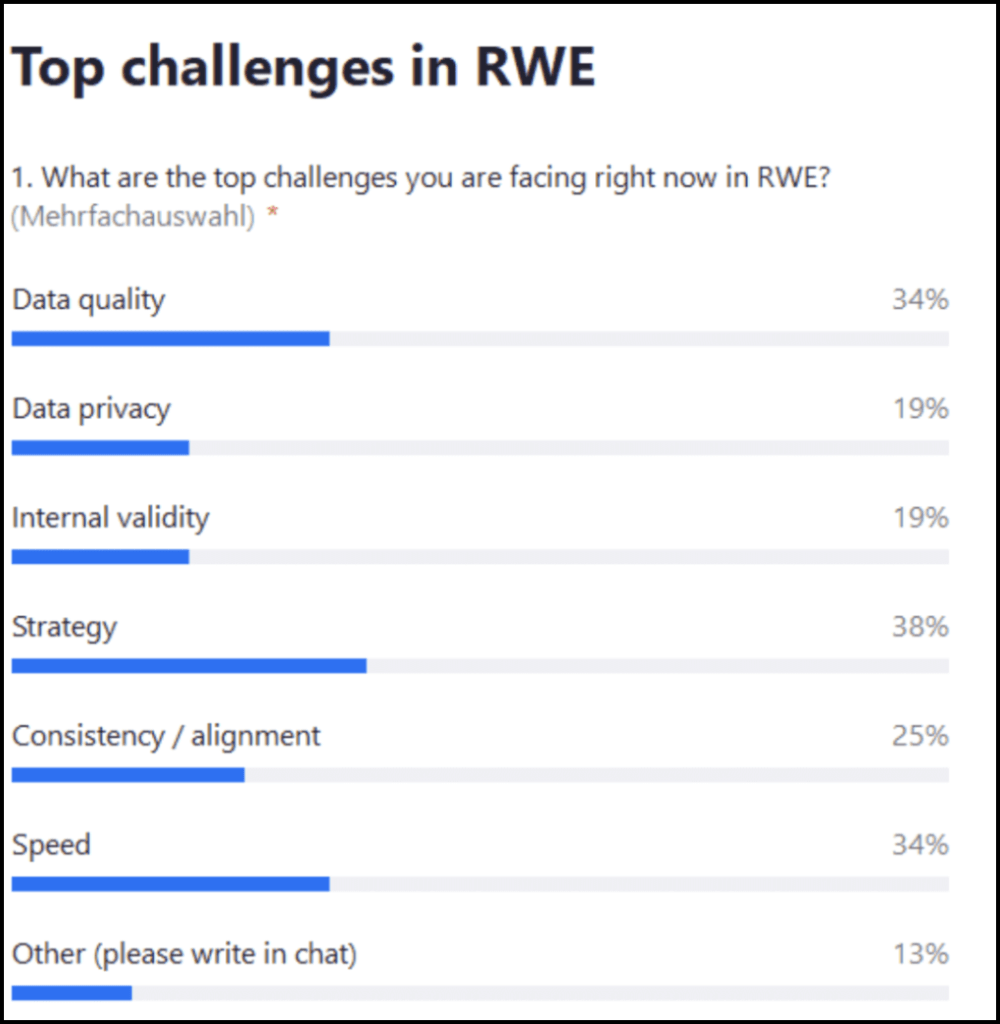
Das Thema unseres Webinars lautete “Global denken, lokal handeln: Bewährte Praktiken für eine ganzheitliche Evidenz in der realen Welt”. Der Austausch begann mit einer Live-Umfrage im Publikum:
Live-Abstimmung: Was sind die größten Herausforderungen, denen Sie sich derzeit in Bezug auf RWE stellen müssen?
Die am häufigsten genannte Antwort war Strategie (38%), gefolgt von Geschwindigkeit und Datenqualität (jeweils 34%), Konsistenzabgleich (25%) sowie Datenschutz und interne Validität (19%). Einige wenige Teilnehmende erwähnten auch die Extrahierung anderer Daten aus Patientenakten.
Die folgenden Fragen richteten sich an Paul.
Was denkst du über diese Ergebnisse, mit welchen davon bist du einverstanden und was überrascht dich vielleicht an den Antworten?
Paul: Ich denke, dass sie alle von Bedeutung sind, und es ist definitiv eine gute Verteilung. Ich stimme zu, dass die Strategie ganz oben auf der Liste stehen sollte. Meine zweite Wahl wäre Konsistenz und Ausrichtung. Das sind die beiden, die meiner Meinung nach am wichtigsten für diese Frage sind. Wenn es um die Generierung von Fakten auf globaler und lokaler Ebene geht, ist das größte Problem, das wir haben, die Kohärenz. Wenn wir also strategisch über die Generierung von Evidenz nachdenken und darüber, wie wir arbeiten, brauchen wir eine übergreifende globale Strategie.
Es gibt einen Weg, auf den man hinarbeitet, aber das wird sehr schnell kompliziert; denn wie wir wissen, leben wir in einem globalen Umfeld. Und auf lokaler Ebene haben die verschiedenen Länder unterschiedliche Gesundheitssysteme und Märkte. All das wirkt sich auf die lokale Strategie aus, sodass die globale und die lokale Strategie nicht immer übereinstimmen.
An dieser Stelle wird Konsistenz wirklich wichtig: Wir beginnen mit der globalen Strategie und müssen sicherstellen, dass die von uns erarbeiteten Erkenntnisse konsistent sind. Sie können von den lokalen Bedürfnissen abweichen, jedoch können wir diese nicht ignorieren und müssen sie berücksichtigen.
Das kann eine Herausforderung darstellen. Sobald wir diese Strategie haben, sollten wir unter anderem über die Fragen nachdenken, die wir beantworten wollen. Das bedeutet, dass wir viele Fragen beantworten und eine Menge Beweise aus der RWD gewinnen können, aber ist das wirklich wichtig für unsere Kunden? Mit Kunden meine ich das gesamte Spektrum, d.h. von unseren Patient:innen, die unsere wichtigsten Kunden sind, bis hin zu Gesundheitssystemen wie Gesundheitsdienstleistern, Kostenträgern und Regierungen, mit denen wir zusammenarbeiten. Sie alle haben sehr unterschiedliche Bedürfnisse und Fragen.
Wir müssen also herausfinden, welche Fragen am wichtigsten sind und wie wir die Prioritäten setzen können. Wie wir dabei vorgehen, ist sehr wichtig.
Wie können wir auf ganzheitliche Weise Nachweise erbringen?
Paul: Eine meiner wichtigsten Botschaften in meinem Unternehmen lautet: Fangen Sie früh an. Jedem, mit dem ich über die Generierung ganzheitlicher Real-World Evidence spreche, sage ich, dass man extrem früh damit starten muss.
Wenn wir eher traditionell denken, durchlaufen wir in der Regel den Lebenszyklus der verschiedenen Studienphasen und beginnen erst in Phase III, also zu spät, über ganzheitliche Real-World Evidence nachzudenken. Oft denken wir nicht an die frühen Erkenntnisse über die Inzidenzprävalenz usw. entlang der Patientenreise.
Der zweite wichtige Punkt ist das Verständnis des Systems. Bei Nachweisen müssen wir wissen, welche Daten bereits vorhanden sind. Denken Sie z.B. an Veröffentlichungen: Gibt es bestehende Literaturressourcen zu unserem Krankheitsgebiet? Das wird sich auf die Maßnahmen auswirken, die wir im Laufe des Lebenszyklus ergreifen müssen.
Zu den wichtigsten Fragen gehören:
- Müssen wir neue Daten generieren oder müssen wir etwas vorausschauend tun?
- Können wir vorhandene Daten nutzen?
- In welchen Markt gehen wir?
- Was ist in der lokalen Landschaft verfügbar? Denken Sie zum Beispiel an Deutschland im Vergleich zu Spanien, Frankreich, China, den USA und Mexiko – was ist dort verfügbar?
Die Antworten können in Bezug auf unsere Kunden, d.h. die Gesundheitssysteme, Patient:innen und Gesundheitsdienstleister, und die von ihnen gesuchten Nachweise unterschiedlich ausfallen. Dazu müssen wir die Strategie unseres Unternehmens kennen; denn sie wird sich auf alles auswirken, was auf diesem Weg geschieht.
Wenn die Strategie des Unternehmens darin besteht, sich auf eine bestimmte Unterpopulation innerhalb eines Krankheitsbereichs zu konzentrieren, müssen wir sicherstellen, dass wir mit dieser Bevölkerungsdefinition übereinstimmen. Schließlich wollen wir nicht fünf verschiedene Definitionen für nicht-kleinzelligen Lungenkrebs oder Herzinsuffizienz haben.
Das mag bei der Erstellung von Evidenz notwendig sein, jedoch wollen wir mit der gleichen Grundlage beginnen. Wir wissen, dass es immer mehr Unternehmen, Gruppen, Wissenschaftler:innen usw. gibt, und sie alle werden immer versierter. Das Verständnis für die Evidenzgenerierung in der Epidemiologie und die Methoden, die wir für unsere Arbeit nutzen, sind hier entscheidend. Wenn wir diesen Nachweis erbringen, werden diese Fragen zu uns kommen.
Die Menschen vor Ort werden unseren lokalen Niederlassungen solche Fragen stellen, und sie müssen bereit sein, sie zu beantworten. Dabei kann es etwa darum gehen, warum wir bestimmte Bevölkerungsgruppen anders definiert haben, wie wir bei der Generierung von Beweisen vorgegangen sind oder warum wir sie für zwei verschiedene Fälle unterschiedlich definiert haben. Aus diesem Grund komme ich immer wieder auf die Konsistenz als grundlegenden Weg zurück.
Gibt es einige allgemeine bewährte Verfahren, die Sie uns aus dem Bereich ganzheitliche Real-World Evidence mitteilen könnten?
Paul: Zunächst sollten Sie von der übergreifenden Strategie Ihrer ganzheitlichen Pläne zur Generierung von Nachweisen ausgehen. Wir können Studien und Marktzulassung nicht als einen Bereich betrachten und ganzheitliche Real-World Evidence sowie die Zeit nach der Vermarktung als einen anderen. Es ist wichtig, dies ganzheitlich zu betrachten, von den frühen Studien über den gesamten Lebenszyklus hinweg, und zu überlegen, was wir aus der Perspektive der realen Welt und der Zeit nach der Vermarktung generieren. Wir müssen von dort aus denken und einige Prioritäten setzen.
Wir haben einen globalen Plan zur Generierung von Evidenz und wir müssen wissen, worauf wir uns lokal konzentrieren. Vielleicht haben wir auf globaler und lokaler Ebene nicht dieselbe Prioritätenliste, aber wir sollten wissen, welche Prioritäten wir setzen. Nehmen wir an, unsere Firma, die auf Unternehmens- bzw. globaler Ebene agiert, sollte sich auf 10 Fragen konzentrieren. Die lokale Niederlassung hingegen sieht vielleicht nur 5 dieser Fragen als wichtig an und konzentriert sich nur auf diese. Nichtsdestotrotz ist es wichtig, konsistent zu sein und sicherzustellen, dass wir in allen Regionen ähnliche Ergebnisse erzielen. Ähnlich ist hier das Schlüsselwort; denn ich verstehe vollkommen, dass die Definitionen und die Methodik wahrscheinlich nuanciert sein werden. Aber wir müssen von der gleichen Grundlage ausgehen, wenn wir vorankommen wollen.
Die bidirektionale Kommunikation ist ein schwieriges Thema, aber sie steht wahrscheinlich ganz oben auf der Liste der besten Praktiken. Es geht darum zu verstehen, was das Unternehmen auf globaler Ebene tut und was die lokalen Bedürfnisse sind. Die lokale Ebene muss genau wissen, was die globale Ebene tut und umgekehrt. Diese Hin- und Her-Kommunikation sorgt für Konsistenz und für ein Verständnis dessen, was wir tun.
Der letzte Punkt, der sich auf die Umsetzung bezieht, betrifft die Kohärenz. Wir wollen bei der Planung verstehen, welche Nachweise wir erbringen werden und warum es zu Abweichungen kommen kann. Um noch einmal auf die Definition zurückzukommen: Wenn wir versuchen, Herzinsuffizienz in zwei Studien unterschiedlich zu definieren (sagen wir, in einer in Japan und in einer in den USA), dann wird die Definition leicht unterschiedlich ausfallen. Wir müssen verstehen, warum wir das tun, und uns darauf einstellen, warum es hier eine Nuance gibt.
Wie wir wissen, leben wir in einer globalen Welt, und was auch immer in Japan getan wird, die USA werden davon erfahren. Nur weil etwas auf einem lokalen Markt oder in einem Land gemacht wird, heißt das nicht, dass andere nichts von dieser Beweisführung mitbekommen werden.
Eine kurze Anekdote: In einer meiner früheren Rollen habe ich in diesem Bereich gearbeitet und wir standen mit einem Kunden über die Erstellung von Nachweisen im Gespräch. Es gab eine kleine Zusammenfassung, die in Europa erstellt und auf einer Konferenz vorgestellt wurde. Der Kunde hatte diese Zusammenfassung gesehen und gesagt: “Wir haben diese Zusammenfassung gesehen und möchten diese Studie in unserer Population in einem Gesundheitssystem in den USA replizieren.” Nun wissen wir, dass die Gesundheitssysteme in den verschiedenen Regionen sehr unterschiedlich funktionieren. Wenn wir also genau diese Studie aus Italien in den USA wiederholen würden, würde sie ganz anders aussehen.
Deshalb müssen wir in der Lage sein, wichtige Punkte zu vermitteln, wie z.B.: “Aus diesem Grund wurde es in Italien so gemacht. Wenn wir es in Ihrem Gesundheitssystem in den USA machen wollen, müssen wir es deshalb anders machen.” Die Gesundheitssysteme, die Kostenträger und die Ärzt:innen vor Ort verfügen über ihre eigenen Daten, sodass sie einen großen Teil der Arbeit, die wir mit ihren Daten leisten, wiederholen können. Wir müssen in der Lage sein, zu verstehen, was und wie es generiert wird.
So können wir bei diesen Gesprächen erklären, warum es Nuancen gibt und warum die Ergebnisse anders aussehen. Natürlich ist den meisten in unserer Gemeinschaft bewusst, dass es Unterschiede geben wird. Das heißt aber nicht, dass wir nicht versuchen werden, die Dinge weltweit zu reproduzieren.
Frage: Wie möchten Sie angesichts der verschiedenen Definitionen, die in der Praxis verwendet werden, von SNOMED CT bis ICD-10 usw., eine einheitliche Standarddefinition für eine Krankheit erreichen?
Paul: Ich bin großer Befürworter des gemeinsamen Datenmodells Odyssey. In Europa gibt es eine Initiative namens Eden, bei der meines Wissens rund 200 Datenpartner in ganz Europa bereits das gemeinsame Datenmodell verwenden. Das ist wirklich wertvoll und führt uns zu unserer Frage nach der Konsistenz; denn mit Hilfe der Technologie zur Standardisierung gemeinsamer Datenmodelle können Sie Analysen über sehr unterschiedliche Datenquellen hinweg durchführen, sowohl in Bezug auf die Variablen als auch auf die Art und Weise, wie sie Dinge definieren. Man wird auf Daten stoßen, bei denen die Ergebnisse sehr unterschiedlich aussehen, und das müssen wir verstehen und kommunizieren können.
Einiges davon kann eine reine Definitionsfrage sein und wie sich das alles in ein gemeinsames Format übersetzen lässt, aber manches kann auch mit der Bevölkerung und der Art und Weise zusammenhängen, wie die Medizin dort anders praktiziert wird. Zum Beispiel gibt es dort vielleicht andere Leitlinien als in anderen Ländern. Wir müssen uns dieser Art von Informationen in Zukunft bewusst sein. Ich persönlich mag OMOP (Observational Medical Outcomes Partnership) und denke, dass es eine gute Möglichkeit ist, Dinge auf der ganzen Welt zu replizieren. Es gibt noch andere Formate und Möglichkeiten, wie wir dies nutzen können.
Frage: Was die Strategie und die Konsistenz betrifft, wie früh im Entwicklungsprozess ist RWE involviert – präklinisch oder später?
Paul: Das ist keine leichte Frage. Ich würde es gerne in der frühen präklinischen Phase sehen. Aber realistisch betrachtet, ist es wahrscheinlich Phase II. Das ist die traditionelle Denkweise, wenn es darum geht, ganzheitliche Real-World Evidence von Anfang an einzusetzen. Die Inzidenzprävalenz der Patientenpopulation, d.h. das Verständnis der Population, an der man sein Molekül ausprobieren will, steht ganz am Anfang.
Aber wir müssen sicherstellen, dass innerhalb des Unternehmens verstanden wird, dass es sich in diesem Stadium tatsächlich um ganzheitliche Real-World Evidence handelt. Das sind Daten, die jetzt eintreffen, und wir sollten uns darauf konzentrieren, denn manchmal schieben wir sie beiseite und sagen: “Naja, wir warten, bis wir in Phase II oder III sind.”
Meiner Meinung nach ist das zu spät; in vielen Fällen zeigen unsere Studienendpunkte und die Art und Weise, wie unsere Studien konzipiert sind, dass das Molekül funktioniert. Das ist das Ziel einer Phase-III-Studie. Sobald wir mit der Studie beginnen, müssen wir sie auf ganzheitliche Real-World Evidence übertragen. Und die Art und Weise, wie wir Daten erheben, die Art und Weise, wie verschiedene Gesundheitssysteme arbeiten, kann dazu führen, dass diese Endpunkte nicht auf die gleiche Weise erfasst werden. Darüber müssen wir uns also frühzeitig Gedanken machen.
Es gibt noch eine weitere Frage zum Problem fehlender Daten, die etwas anders gelagert ist, weil wir nicht über fehlende Datenpunkte wie das Gewicht einer Patientin bei jedem Besuch sprechen. Stattdessen geht es um bestimmte Bevölkerungsgruppen, z.B. ethnische Minderheiten oder Frauen. Das ist ein großes Problem in den USA. Die FDA hat Leitlinien zur Vielfalt in unseren Studien hinzugefügt. Wenn wir also in einem klinischen Umfeld zu RWD übergehen, wird dies die Vielfalt erfassen, die in klinischen Studien möglicherweise nicht erfasst wird.
Dem stimme ich in gewissem Maße nicht zu. Wenn man sich insbesondere den US-Markt ansieht, gibt es viele Menschen ohne Krankenversicherung. Wenn man also keine Versicherung hat, geht man nicht zum Arzt oder zu Gesundheitsdienstleistern, also fehlt man in diesen Daten. Es spielt keine Rolle, ob wir RWD betrachten – Sie suchen überhaupt keine Gesundheitsversorgung auf. Es gibt noch viele andere Gründe dafür, warum diese Daten nicht erhoben werden.
Deshalb müssen wir über neue Arbeitsweisen nachdenken, wie wir diese Bevölkerungsgruppen ansprechen und sicherstellen können, dass sie sich mit der Teilnahme an der Forschung und der Erfassung ihrer Daten wohlfühlen. Es gibt noch viel mehr Gründe, warum sie nicht zum Arzt gehen, sich nicht für klinische Studien interessieren oder nicht wollen, dass ihre Daten erfasst werden, als nur den Gang zum Arzt.
Damit gehen wir auf die kommunale Ebene zu – das ist reine Gesundheitsarbeit, und wir müssen viel früher damit anfangen, damit die Menschen sich engagieren und mitmachen.
Frage: Unsere kürzlich durchgeführte Patientenbefragung hat gezeigt, dass 76% der Patient:innen gesundheitsbezogene Informationen digital versenden und empfangen möchten, aber dennoch den persönlichen Kontakt und das Einfühlungsvermögen des medizinischen Personals schätzen. Was bedeutet dies Ihrer Meinung nach für die Zukunft der klinischen Studien?
Paul: Wenn ich es überspitzt formuliere, ist Hybrid der Begriff der Zukunft, weil wir dazu neigen, uns auf das zu konzentrieren, was gerade im Trend liegt. Mit Covid haben wir einen Anstieg dezentraler Studien erlebt, bei denen wir uns auf ein völlig neues Design konzentrieren und uns von unseren traditionellen RCTs entfernen.
Und selbst bei der Generierung von ganzheitlicher Real-World Evidence und allgemeiner Evidenz können wir anfangen, neue Methoden zu untersuchen, ohne ganzheitlich zu denken. Daher denke ich, dass es viel mehr Mischformen und einen Mix geben wird. Ich mag pragmatische Studien sehr, weil man dort das ganze Spektrum hat: Von einer wirklich pragmatischen Studie, bei der man nur randomisiert und RWD ohne zusätzliche Daten einsetzt, bis hin zu einer typischen RCT mit einigen erweiterten Daten aus der realen Welt.
Das sind die beiden Extreme und vieles liegt irgendwo dazwischen. Man kann viel aus der RWD herausholen, aber man muss sie vielleicht in gewissem Maße ergänzen. Das bringt uns zum zweiten Punkt über Effizienz. Das Ideal ist das, was für Ihre spezifische Forschungsfrage am besten funktioniert. Es ist nicht so, dass Sie die Methode nicht an die Frage anpassen können – Sie werden Ihre Frage haben, mit der Sie beginnen und dann herausfinden, wie Sie am besten vorgehen. Es ist auch wichtig, dass man es nicht erzwingt, denn wir haben immer wieder gesehen, dass das am Ende zum Scheitern führt. Eine Methode oder ein Design zu erzwingen, wird einfach nicht funktionieren.
Dann habe ich die personalisierten Therapien erwähnt, weil ich glaube, dass sie sich weiter entwickeln werden. Wir müssen über neue hybride Wege nachdenken, um Antworten auf unsere Forschungsfragen zu erhalten. Diese Populationen werden sehr zielgerichtet sein und es wird schwierig sein, eine traditionelle Studie durchzuführen, sei es eine reale oder eine klinische Studie.
Frage: Wie gewährleisten Sie angereicherte Qualitätsdaten?
Paul: Ich gehe eigentlich vom Patienten oder dem Endnutzer aus, der unsere Moleküle oder Technologien verwenden wird. Wir müssen also darüber nachdenken, wie wir die Belastung für sie verringern können. Es gibt viele Gründe für die geringe Beteiligung an herkömmlichen Studien, einer der häufigsten ist der Zeitaufwand. Menschen sind damit beschäftigt, Prüfzentren aufzusuchen, Fragebögen auszufüllen usw. Wie können wir also die Belastung für Patient:innen so weit wie möglich reduzieren und gleichzeitig die besten Qualitätsdaten erhalten?
Wir bewegen uns in eine Richtung, in der dies immer einfacher gelingt. Technologie ist dabei der Schlüssel. So ist etwa die Linkage-Tokenization in den USA derzeit ein großes Thema, d.h. die Möglichkeit, unterschiedliche Datenquellen miteinander zu verknüpfen, um diese Daten zu verbessern. Ich glaube, dass dies dramatisch zunehmen wird und dass es immer einfacher werden wird, dies zu tun.
Das wichtigste Element bei allem, was wir in Zukunft tun werden, ist Transparenz. Und zwar Transparenz in allen Bereichen. Wir neigen dazu, Transparenz aus der Datenperspektive zu betrachten und darüber nachzudenken, was wir an die FDA übermitteln oder an Prüfer, Standorte, Behörden, Gesundheitssysteme usw. zurückmelden.
Was man aber nicht hört, ist die Frage, ob wir sicherstellen, dass unsere Patient:innen die Informationen aus unseren Studien erhalten. Ich denke, das hängt von unserer Fähigkeit ab, Technologie und Daten zu nutzen, denn die Menschen verstehen, wie und warum Sie ihre Daten verwenden.
Letzten Endes handelt es sich bei den Daten, die wir verwenden, nicht um die Daten des Gesundheitssystems oder des Kostenträgers. Es sind die Daten der Patient:innen. Wenn Sie sich dessen bewusst sind, werden einige dieser Aufgaben viel einfacher.
Live-Abstimmung: Wie erfahren sind Sie mit klinischen Registern?

Paul: Die Verknüpfung erfolgt durch die Verwendung persönlicher Daten wie Name, Geburtsdatum, Adresse, Sozialversicherungsnummer und Behördenausweis, um einen verschlüsselten Code hinter der Firewall zu generieren. Dieser Code wird dann als Token oder als Verbindungsmöglichkeit für Daten betrachtet und in verschiedenen Datenquellen angewendet. Mithilfe spezieller Software können diese Codes entschlüsselt werden, um Überschneidungen zu ermitteln und festzustellen, wo die Verknüpfung stattgefunden hat.
Sobald dieser Prozess abgeschlossen ist, werden die Daten, wenn sie für Forschungszwecke genutzt werden sollen, einer Zertifizierung für die Einhaltung des HIPAA unterzogen, was dem GDPR in Europa entspricht. Nach erfolgreicher Zertifizierung bleibt die Anonymität der Daten gewahrt, und sie können für Forschungszwecke in Europa verwendet werden. Sobald dieser verschlüsselte Code erstellt ist, der nach HIPAA und in den USA nicht als personenbezogene Daten außerhalb der USA gilt, werden die Daten als personenbezogen betrachtet.
Dieser Trend breitet sich auch im Vereinigten Königreich zunehmend aus, und es gibt Pläne, ihn auf ganz Europa auszuweiten. Der Token, der dabei verwendet wird, stellt eine persönliche Information dar, die streng hinter der Firewall geschützt bleibt. Sobald die Daten verknüpft und pseudonymisiert sind (was sich von der Anonymisierung unterscheidet, wie sie in den USA verstanden wird), stehen sie Ihnen zur Nutzung für Ihre Arbeit zur Verfügung.
Nun zur zweiten Frage bezüglich der Rolle der Einwilligung der Patient:innen im Zusammenhang mit der Real-World-Evidence und der Tokenisierung: In meiner Organisation ist dies nicht “nice to have”, sondern eine grundlegende Voraussetzung. Im Gegensatz dazu benötigt man in den USA im Allgemeinen keine ausdrückliche Einwilligung der Patient:innen, um die entsprechenden Daten für die Arbeit mit RWE zu verwenden.
Wenn wir also Tokenisierung nutzen wollen oder für was auch immer wir eine Einwilligung einholen wollen, sollten wir meiner Meinung nach in Zukunft auch für Dinge wie die RWE-Generierung die Einwilligung der Patient:innen einholen. Es erhöht die Transparenz, wenn ein Patient/ eine Patientin zustimmt, daran teilzunehmen, und wir können mitteilen, was wir in den Ergebnissen generieren und wie dies zu seinem persönlichen Datenhintergrund passt. Meiner Meinung nach wird dies die Beteiligung erhöhen und der öffentlichen Gesundheit im Allgemeinen wirklich helfen. Nicht, weil die Patient:innen ihren Daten näher kommen, sondern weil sie sehen: “Oh, diese Forschung wurde durchgeführt, sie sagt XYZ und so passt das zu meinem Profil.” Mit der Technologie sollten wir in der Lage sein, auch für diese Art von Arbeit eine Einwilligung zu erhalten.
In Zukunft halte ich es für angebracht, dass wir für den Einsatz von Tokenisierung oder jegliche Maßnahmen, für die eine Einwilligung erforderlich ist, wie beispielsweise die Generierung RWE, die Zustimmung der Patient:innen einholen. Erhöht die Transparenz, wenn ein Patient oder eine Patientin aktiv in den Prozess einbezogen wird und wir offenlegen können, welche Ergebnisse wir generieren und wie diese mit ihren persönlichen Daten in Verbindung stehen. Meiner Überzeugung nach würde dies die Beteiligung steigern und der öffentlichen Gesundheit im Allgemeinen wirklich zugutekommen. Nicht nur, weil die Patient:innen ein besseres Verständnis für ihre eigenen Daten erlangen, sondern auch, weil sie erkennen können: “Oh, diese Forschung wurde durchgeführt, sie besagt XYZ und das passt zu meinem individuellen Profil.” Angesichts der heutigen technologischen Möglichkeiten sollten wir in der Lage sein, auch für derartige Untersuchungen eine Einwilligung einzuholen.
Frage: Was halten Sie von Registern?
Paul: Ich empfinde es manchmal als überholt, wenn traditionelle, vorausschauende Methoden der Datenerfassung als einzige Lösung betrachtet werden. In einem meiner früheren Jobs in der Industrie habe ich in einem Bereich für seltene Krankheiten gearbeitet, in dem ein Bedarf an Daten bestand. Angesichts der Annahme, dass diese Daten in der realen Welt nicht verfügbar waren, entschieden wir uns, ein prospektives Register zu erstellen. Wir überlegten uns zunächst die Fragen, die wir den Patient:innen stellen wollten. Als ich eine PDF-Datei mit den Fragen, die ich vor der Implementierung des Registers durchsehen sollte, erhielt, war ich überrascht festzustellen, dass sie 67 Seiten umfasste. Wenn wir nun über die Belastung der Patient:innen nachdenken und darüber, wie das alles zusammenpasst, welchen Wert hat es dann für die Patient:innen, all diese Informationen regelmäßig auszufüllen? Und wie können wir diese Daten nutzen?
Ich glaube fest an die Idee der “Zweckmäßigkeit”. Dennoch denke ich, dass wir zu einem Hybridmodell zurückkehren müssen. Es kommt darauf an, wonach man sucht und wo die voraussichtlichen Daten benötigt werden. Wir haben zum Beispiel Wearables, Krankenakten, Apps, Anträge usw. Es gibt also viele Quellen, die wir nutzen können, und und wir können selektiv das hinzufügen, was für die Erweiterung dieses Registers erforderlich ist.Ich verwende bewusst Anführungszeichen, nicht um den Begriff an sich zu überdenken, sondern um zu betonen, dass wir seine Definition neu gestalten können.
Viele Menschen denken immer noch an Register im traditionellen Sinne, von dem wir uns meiner Meinung nach allmählich entfernen. Aber es gibt viele Technologien, die uns dabei helfen, reale Patientendaten zu nutzen und sie beispielsweise durch Wearables zu ergänzen und ihnen dann 3-5 Fragen statt 50 Fragen zu stellen. Das ist meiner Meinung nach die Zukunft von RWE.
Frage: Die Patientenbindung in den Phasen nach der Markteinführung von Real-World-Evidence (RWE) ist bekanntermaßen gering. Wie können wir diese verbessern?
Einige neuere Organisationen verwenden ein Anreizmodell. Dabei bezahlen wir nicht direkt für die Datenperspektive, aber die Patient:innen haben die Möglichkeit, Belohnungen zu erhalten, wenn sie teilnehmen oder ihre Daten einreichen. Dennoch betrachten wir die Daten als wertvolles Gut, das kontinuierlich genutzt wird.
Ich denke, das wird uns auch in gewissem Maße bei der Rekrutierung helfen. Es wird weiterhin eine Planung der Transparenz und des Mehrwerts geben. Ich meine nicht den Mehrwert aus der Sicht der Patient:innen. Was bringt es ihnen, ihre Daten zu übermitteln und Fragen zu beantworten? Sie müssen erkennen können, ob ihre Beteiligung tatsächlich einen Einfluss auf die Forschungsergebnisse hat, ob die Ergebnisse veröffentlicht werden, ob neue Behandlungsmöglichkeiten verfügbar sind oder wie ihre eigene Behandlung davon profitieren kann. Infolgedessen wird das Medikament viel wirksamer sein. Wir müssen also die Patient:innen darüber informieren und ihnen helfen, zu erkennen, was tatsächlich geschieht. Wir sollten ihre Daten nicht einfach nur nehmen, um damit eine ansprechende Publikation zu erstellen.
Frage: Wie steht es um Datenextraktion aus elektronischen Patientenakten, ethischen Genehmigungen usw.?
Paul: Dies ist ein Bereich, den ich als äußerst entscheidend betrachte, in dem RWD oder klinische Daten eine Schlüsselrolle spielen. Hierbei wird beispielsweise EDC genutzt, um RWD zu erfassen und sie in das elektronische Format für eine klinische Studie zu überführen. Bevor ich in die Branche kam, war ich Mitglied der Ethikkommission eines Krankenhauses, in dem ich arbeitete. Diese Gremien sind äußerst wertvoll, weil sie prüfen, wie die Daten verwendet werden, die Sicherheit der Patient:innen gewährleisten und sicherstellen, dass wir uns ethisch korrekt verhalten. Das ist notwendig und sollte nie vernachlässigt werden. Was die Zustimmung und die ethischen Genehmigungen angeht, so brauchen wir diese unabhängig davon, wie wir die Daten erhalten.
Vielen Dank, Paul, für das aufschlussreiche Gespräch! Um die Aufzeichnung der gesamten Sitzung zu sehen, klicken Sie hier.






