Die Vielfalt macht den Unterschied – Diversität in klinischen Studien

DATUM
15. Dezember 2021
AUTOR
Benjamin Sauer | VP Engineering
Diversität und Inklusion werden heutzutage in fast jedem Unternehmen groß geschrieben. Dabei soll aktiv darauf geachtet werden, dass Chancen gleich verteilt sind und niemand beim Zugang zu Karrieremöglichkeiten aufgrund Faktoren wie Geschlecht, Alter oder ethnischer Zugehörigkeit benachteiligt wird. Im klinischen Umfeld gibt es jedoch noch ein Gebiet, das dringenden Handlungsbedarf im Hinblick auf Diversität hat: Klinische Studien.
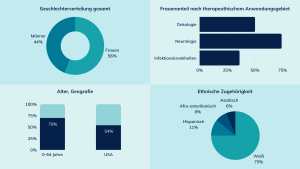
Im Jahr 2020 wurden von der Food and Drug Admission (FDA) – dem US-amerikanischen Äquivalent des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) – 53 neue Arzneimittel zugelassen. Laut Summary Report 2020 aus der von der FDA herausgegebenen Drug Trials Snapshot-Serie sind 75% der Patient:innen in den Zulassungsstudien für diese Arzneimittel weiß. Die Gruppe der Afroamerikaner hat einen Anteil von 8%, 6% der Patient:innen haben eine asiatische ethnische Zugehörigkeit und 11% eine hispanische. Was das Alter betrifft: Nur 30 Prozent der Patient:innen sind 65 Jahre alt oder älter, dabei treten gerade in der älteren Bevölkerung mehr behandlungsbedürftige Erkrankungen auf. Während es bei der Geschlechterverteilung mit 56% Frauenanteil allgemein relativ ausgeglichen war, zeigt sich beim genaueren Blick auf bestimmte Erkrankungen ein Ungleichgewicht: Bei Arzneimitteln zur Behandlung neurologischer Erkrankungen waren 74% der Patient:innen weiblich, wobei es bei den Infektionserkrankungen nur 36% waren (Abb. 1).
Abbildung 1. Stichprobenzusammensetzung in Zulassungsstudien der 2020 durch die FDA zugelassenen Arzneimittel. Quelle: Drug Trials Snapshots Report (2020) der FDA.
Welche Kriterien spielen eine Rolle?
Um den Grad der Diversität in einer klinischen Studie einschätzen zu können, müssen verschiedene Charakteristika der Studienstichprobe betrachtet werden. Alter, Geschlecht und ethnische Zugehörigkeit fallen hier direkt ein und diese sind wichtige demografische Kriterien ebenso wie der Wohnort der Patient:innen. Doch es gibt auch nicht-demografische Kriterien, die berücksichtigt werden müssen, z.B. Komorbiditäten, Behinderungen, Patient:innen mit Organfehlfunktionen, Personen mit extrem niedrigem bzw. hohem Body-Mass-Index (BMI) und Bevölkerungsgruppen mit Erkrankungen mit niedriger Prävalenz.
Warum brauchen wir Diversität in klinischen Studien?
Eine wesentliche Rolle in klinischen Studien spielt die Repräsentativität der Stichprobe. Denn sie ermöglicht, dass die Ergebnisse einer kleinen Auswahl an Personen auf eine größere Gruppe an Personen übertragen werden können. Da es bei der Vielzahl an klinischen Studien, die zu den unterschiedlichsten Themen durchgeführt werden, nicht möglich ist, dass jeder Mensch auf der Welt an jeder Studie teilnimmt, ist diese Repräsentativität das A und O für erfolgreiche Studien. Und genau hier ist Diversität wichtig, da homogene Probandengruppen zu verzerrten Forschungsergebnissen führen können und somit zu für einige Patientengruppen weniger wirksamen oder sogar ungeeigneten Medikamenten und Medizinprodukten.
Zahlreiche Medizinprodukte, bei denen Unterschiede in der Wirksamkeit im Zusammenhang mit ethnischer Zugehörigkeit auftraten, untermauern dies. Zum Beispiel können Unterschiede in der Hautstruktur und -physiologie insbesondere bei dermatologischen Produkte einen Einfluss haben.
Ebenso wichtig für die Evaluation der Wirksamkeit von Medizinprodukten und Arzneimitteln ist die Berücksichtigung des Alters. Auch hier gibt es einige Ergebnisse, die auf eine unterschiedliche Wirksamkeit in unterschiedlichen Altersgruppen hinweisen. Faktoren wie eine veränderte Knochendichte, Veränderungen des Stoffwechsels und der Verdauung müssen hier miteinbezogen werden.
Als letztes Beispiel in dieser kleinen Auswahl an vorhandenen Forschungsdaten sind die seltenen Erkrankungen zu nennen. Da nur eine kleine, geografisch oft verstreute Patientengruppe von ihnen betroffen ist, muss hier der Aufwand maximiert werden, um möglichst viele Patient:innen für die Teilnahme an einer klinischen Studie zu gewinnen.
Wie erhöht man die Diversität in klinischen Studien?
Als Erstes lohnt es, die Zulassungskriterien in einer Studie zu erweitern. Oft sind die Einschlusskriterien sehr eng gefasst, um Patient:innen vor Risiken der Teilnahme zu schützen, die den Nutzen der Studie klar übertreffen. Dies ist in Zulassungsstudien vor allem bei Patient:innen mit Einschränkungen der Leber- und Nierenfunktion der Fall, da wenige Informationen darüber vorhanden sind, wie die Dosierung in diesen besonderen Fällen aussehen soll. Auch schwangere und stillende Patientinnen werden häufig aufgrund mangelhafter Referenzwerte aus Studien ausgeschlossen. Doch auch ohne stichhaltige klinische oder wissenschaftliche Begründung werden Patient:innen standardmäßig aus Studien ausgeschlossen, etwa aufgrund von hohem Alter, extremem Gewicht oder aufgrund einer HIV-Infektion. Eine Ausweitung der Einschlusskriterien kann hier bereits zu mehr Diversität in der Stichprobe führen.
Manche Patient:innen können jedoch nicht an einer Studie teilnehmen, da sie zum Beispiel aufgrund von Arbeitszeiten nur am Abend oder am Wochenende Zeit für die Teilnahme finden oder aufgrund ihrer Erkrankung oder ihrem Alter nicht in der Lage sind, den Weg ins Studienzentrum auf sich zu nehmen. Hier kommt die zweite Empfehlung der FDA zu Tragen, auf ein anderes Studiendesign umzusteigen, um die Rekrutierung zu verbessern und die Teilnahme für die Patient:innen so angenehm wie möglich zu gestalten.
Auch dem deutschen Wissenschaftsrat ist die schlechte Verankerung der Patientenorientierung in Deutschland nicht entgangen und daher hat er für klinische Studien die Empfehlung ausgesprochen, schon bei der Konzeption auf mehr Einbezug der Patient:innen zu achten und die Patientensicht bei klinischen Studien konsequent zu berücksichtigen.
Dezentrale klinische Studien für mehr Patientenorientierung und Diversität
Um die eben genannte Patientenorientierung zu erreichen und Patient:innen die Teilnahme an klinischen Studien so angenehm wie möglich zu machen, sind dezentrale klinische Studien (engl. Decentralized Clinical Trials = DCTs) eine optimale Studienform. Durch den Einsatz von Telemedizin, mobilen bzw. lokalen Gesundheitsdienstleister und/oder mobilen Technologien sind diese Studien nicht an einen spezifischen geografischen Ort gebunden und erlauben es so einer größeren und diverseren Gruppe an der Studie teilzunehmen. Es gibt eine große Spannbreite der DCTs über hybride Zwischenformen, die nur dezentrale Elemente enthalten, bis hin zu vollständig virtuellen Studien. Jedes dezentrale Element erleichtert die Teilnahme an der Studie, da oft nicht nur die örtliche Flexibilität, sondern auch die zeitliche, erhöht wird.
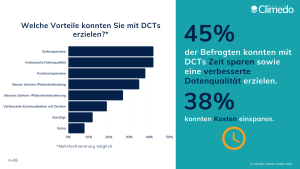
Für die Durchführung von DCTs werden digitale Lösungen benötigt. Ein sicheres, cloud-basiertes System bietet die Möglichkeit, die Studie in Echtzeit aus der Ferne zu überwachen und Studienprozesse zu automatisieren. Und auch für Sponsoren lohnt sich die Implementierung von dezentralen klinischen Studien: Zeitersparnisse, eine verbesserte Datenqualität und Kostenersparnisse sind die top drei der Vorteile, die mit DCTs erzielt werden können. Doch auch Patient:innen spüren die Vorteile, da ein Großteil der benötigten Studiendaten bequem von ihrem Zuhause aus erfasst werden kann. Dies zeigte sich auch in unserer aktuellen Umfrage zum Stand der Nutzung von DCTs: Eine bessere Rekrutierung und Bindung von Patient:innen und Zentren zählten zu den wichtigsten Vorteilen der DCT-Nutzung (Abb. 2).
Abbildung 2. Erzielte Vorteile durch DCT-Nutzung.
Fazit
Diversität hilft dabei, die Ergebnisse aus klinischen Studien auf die breite Bevölkerung übertragen zu können. Stand heute ist diese jedoch in vielen Studien noch nicht angekommen und mangelnde Vielfalt in Studienstichproben ein Problem, das in den nächsten Jahren gelöst werden muss. Die Erweiterung der Patientenauswahlkriterien von Studien ist ein wichtiger Schritt ebenso wie die Wahl einer Studienform, die Patient:innen die Teilnahme so einfach wie möglich macht. Dezentrale klinische Studien bieten ein noch nie dagewesenes Maß an Patientenorientierung und ermöglichen durch ihren dezentralen Charakter selbst den Patient:innen eine Studienteilnahme, die normalerweise Schwierigkeiten dabei hätten, den Weg zum Studienzentrum anzutreten.